
����Ŀ����ҵ����������[��Ҫ�ɷ�Ϊ����������FeTiO3��������MgO��SiO2������]Ϊԭ�����Ʊ����������������������������

��֪��������ʱ��FeTiO3ת��ΪFe2+��TiO2+ ��
����ʵ�������£�Ksp[Mg(OH)2]=1.0��10-11��
����Һ������Ũ��С�ڵ���l .0��10-5mol/Lʱ����Ϊ�����ӳ�����ȫ��
���������������
��1��FeTiO3��TiԪ���Ļ��ϼ�Ϊ_____�ۣ��������;Ϊ_____(��дһ�֣���
��2����ˮ��������������Ӧ�����ӷ���ʽΪ________��
��3����������������̬����ĵ���ʽΪ______���ù����������Ӧ���ȵ���35 ����ԭ��Ϊ_______��
��4��FeCO3ת��Ϊ����ʱ��������Ӧ�Ļ�ѧ����ʽΪ____________��
��5����Һ3�������Ʊ�Mg(OH)2������Һ3��c(Mg2+)=1.2��10-3mol/L������������������NaOH��Һ��Ũ��Ϊ________ mol/Lʱ����ʹMg2+ǡ�ó�����ȫ(��Һ����仯��������)��
��6���������ʱ�������Ϊ������CaO����������ӦʽΪ_______���Ƶ�1molTi���ʣ������ϵ�����ͨ���ĵ���Ϊ______��������λ��Ч��������֪��l �����ӵĵ���Ϊ1.6��10-19C ) ��
���𰸡� +4 �Ʊ���ɫ���Ϻ����ᡢұ������ TiO2++2H2O=H2TiO3��+2H+ ![]() ��ֹNH4HCO3�ֽ⣨�����Fe2+��ˮ�⣩ 4FeCO3+O2
��ֹNH4HCO3�ֽ⣨�����Fe2+��ˮ�⣩ 4FeCO3+O2![]() 2Fe2O3+4CO2 4.4��10-3 TiO2+4e-=Ti+2O2- 3.85��105C
2Fe2O3+4CO2 4.4��10-3 TiO2+4e-=Ti+2O2- 3.85��105C
��������������������������ʱ�����������������������ѣ�ͬʱ����þҲ����������þ���������費�ܳ�Ϊ����I�����˺�����������90��ˮ�����������������������ö������ѣ�������ڵĶ��������Ƶý����ѣ���Һ�м���̼����什��������ӳ��������˵�̼��������������������̼�����������졣
��1��FeTiO3���������Ļ��ϼ۷ֱ�Ϊ+2��-2������TiԪ�صĻ��ϼ�Ϊ+4�ۣ��������;Ϊ�Ʊ���ɫ���Ϻ����ᡢұ�����ȡ�
��2����ˮ�⡱�У�������Ӧ�����ӷ���ʽΪTiO2++2H2O=H2TiO3��+2H+��
��3�����������з�����ӦFe2++2HCO3-=FeCO3��+CO2��+H2O����̬����ΪCO2�������ʽΪ![]() ���ù�������Ʒ�Ӧ�¶ȵ���35 �棬�¶ȹ���NH4HCO3��ֽ⣬���һ�ٽ��������ӵ�ˮ�⣬����ԭ��Ϊ��ֹNH4HCO3�ֽ⣨�����Fe2+��ˮ�⣩��
���ù�������Ʒ�Ӧ�¶ȵ���35 �棬�¶ȹ���NH4HCO3��ֽ⣬���һ�ٽ��������ӵ�ˮ�⣬����ԭ��Ϊ��ֹNH4HCO3�ֽ⣨�����Fe2+��ˮ�⣩��
��4��FeCO3ת��Ϊ����ʱ��������Ӧ�Ļ�ѧ����ʽΪ4FeCO3+O2![]() 2Fe2O3+4CO2��
2Fe2O3+4CO2��
��5������Һ3��c(Mg2+)=1.2��10-3mol/L��������Һ���Ϊ1L����n(Mg2+)=1.2��10-3mol,������Щþ����Ҫ����n(OH-)=2n(Mg2+)=2.4��10-3mol,��Ӧ����Һ�����Ϊ2L��c(OH-)= 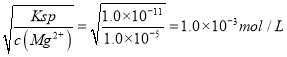 ������n(OH-)��=2.4��10-3mol+2L
������n(OH-)��=2.4��10-3mol+2L![]() mol/L=4.4
mol/L=4.4![]() 10-3mol,�����м���������NaOH��Һ��Ũ��Ϊ
10-3mol,�����м���������NaOH��Һ��Ũ��Ϊ![]() =4.4��10-3 mol/Lʱ����ʹMg2+ǡ�ó�����ȫ��
=4.4��10-3 mol/Lʱ����ʹMg2+ǡ�ó�����ȫ��
��6������⡱ʱ�������Ϊ���ڵ�CaO����������ӦʽΪTiO2+4e-=Ti+2O2-���Ƶ�1molTi���ʣ������ϵ�����ͨ���ĵ���Ϊ4mol������Ϊ
4mol![]() mol-1
mol-1![]() C=3.85��105C��
C=3.85��105C��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ����������������أ�����˵������ȷ���ǣ�������
A. ���øߴ���İ뵼�����ܿ��Ƴɹ���
B. ����ú�������ɻ�ýྻ��ȼ��
C. ��������ˮ���������Կ����ھ�ˮ
D. ���ý��ݹ����������Һ�Ĺ���������ϩ��ʹˮ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���������;��˵���У�����ȷ���ǣ�������
A. Fe2O3���������������
B. ��ˮ���Ե�̲���
C. Al2O3�������ͻ����
D. �����������������ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���г������۵ġ�84������Һ������Ʒ��ʶ�������������� ����ƷΪ��ɫ��Һ���ʼ��� ��ʹ��
ʱ��ˮϡ�� ���ɶԲ;ߡ����������������Ư��dzɫ�·���������Ч�ɷݿ�����
A��Cl2 B��SO2 C��NaClO D��KMnO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£��ڹ̶��ݻ����ܱ������У����淴ӦA(g)+3B(g)![]() 2C(g)�ﵽƽ��ʱ�������ʵ����ʵ���֮����n(A)��n(B) ��n(C)=2��2��l�������¶Ȳ��䣬��2��2��1�����ʵ���֮���ٳ���A��B��C���� ��
2C(g)�ﵽƽ��ʱ�������ʵ����ʵ���֮����n(A)��n(B) ��n(C)=2��2��l�������¶Ȳ��䣬��2��2��1�����ʵ���֮���ٳ���A��B��C���� ��
A. ƽ�����������ƶ� B. ƽ�ⲻ�����ƶ�
C. C�����������С D. C�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���ǣ�������
A. ��С�մ�NaHCO3����������������ͷ
B. ��Al��OH��3��������
C. �����������Һ�Ⱦ���ʹ�������ɫ������ɫ
D. ���ά����Ҫ�ɷ���SiO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���20mL 0.2mol/L H2A��Һ�еμ�0.2 mol/L NaOH��Һ����AԪ�ص��й������ʵ����仯����ͼ��ʾ������ͼʾ�жϣ�����˵����ȷ����
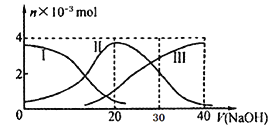
A. H2A��ˮ�еĵ��뷽��ʽ�ǣ�H2A== H++HA-��HA-![]() H++A2��
H++A2��
B. �������Ũ�ȵ�NaOH��Һ��H2A��Һ��Ϻ�����Һ��ˮ�ĵ���̶ȱȴ�ˮ��
C. ��V(NaOH)=30mLʱ����Һ�д������¹�ϵ��2c(H+)+ c(HA-)+ 2c(H2A)��c(A2-)+2c(OH-)
D. ��V(NaOH)=20mLʱ����Һ�и�����Ũ�ȵĴ�С˳��Ϊ��c(Na+)��c(HA-)��c(H+)��c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���������ڳ��ͷŵ�ʱ�����ķ�ӦΪ:
Fe+NiO2+2H2O![]() Fe(OH)2+Ni(OH)2,����˵������ȷ����
Fe(OH)2+Ni(OH)2,����˵������ȷ����
A. �ŵ�ʱ�������Ϸ�����Ӧ��������Fe
B. �ŵ�ʱ��������Ӧ�ǣ�NiO2+2e-+2H+=Ni(OH)2
C. ���ʱ��������Ӧ�ǣ�Ni(OH)2-2e-+2OH-=NiO2+2H2O
D. ���ʱ����������pHֵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����C��s��+CO2��g�� 2CO��g���ķ�Ӧ�У��ֲ�ȡ���д�ʩ������С���������ѹǿ ������̼���� ���ۺ��ݳ���CO2 �ܺ����³���N2 �� ��ѹ�³���N2���ܹ�ʹ��Ӧ��������Ĵ�ʩ�ǣ�������
A. �٢�B. �ڢۢ�C. �٢�D. �٢ڢ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com