
【题目】碘硫化学循环原理如图1所示.
(1)写出反应③的化学方程式 , 一定温度下,向2L密闭容器中加入2mol HI(g),测得n (H2)随时间的变化如图2所示,则该温度下该反应的平衡常数K= .
(2)写出反应①的化学方程式 , 其中SO2体现的是性.
(3)综合①②③三个反应,可看出该化学循环是为了制备某种能源气体,该气体的化学式是 .
(4)氧缺位铁酸铜(CuFe2O4﹣δ)是反应②的良好的催化剂.实验室用如下方法制得:Ⅰ.在Fe(NO3)3和Cu(NO3)2混合溶液中加入一定量KOH溶液,加热
Ⅱ.调节pH并连续搅拌24小时
Ⅲ.过滤、干燥获得铁酸铜(CuFe2O4)
Ⅳ.在氮气保护下、1223K时煅烧CuFe2O4 , 得到CuFe2O3.86
①写出制备得到CuFe2O4的化学方程式
②研究发现:
温度 | 元素存在形式 |
1200﹣1350K | Fe3+部分转变为Fe2+ |
计算CuFe2O3.86中Fe3+与Fe2+的质量百分含量之比为 .
(5)由于该循环中H2SO4与HI发生副反应造成反应器堵塞,因此有科学家用如图3所示原理进行反应.写出阳极的电极反应式 . 请用文字说明在N极能够获得所需物质的原因是 .
【答案】
(1)2HI ![]() H2+I2;
H2+I2;![]()
(2)I2+SO2+2H2O=2HI+H2SO4;还原
(3)H2
(4)2Fe(NO3)3+Cu(NO3)2+8KOH=CuFe2O4+8KNO3+4H2O;43:7
(5)SO2+2H2O﹣2e﹣=4H++SO42﹣;M极附近产生的H+通过质子交换膜移动到N极附近,与I2失电子后得到的I﹣形成HI溶液
【解析】解:(1)由图可知碘化氢分解生成单质碘和氢气,其反应的方程式为:2HI ![]() H2+I2; 2HI
H2+I2; 2HI ![]() H2 +I2
H2 +I2
起始的浓度(mol/L):1 0 0
转化的浓度(mol/L):0.2 0.1 0.1
平衡的浓度(mol/L):0.8 0.1 0.1
则K= ![]() =
= ![]() =
= ![]() ;
;
所以答案是:2HI ![]() H2+I2;
H2+I2; ![]() ;(2)反应①为二氧化硫与单质碘反应生成HI和硫酸,其反应的方程式为:I2+SO2+2H2O=2HI+H2SO4;反应中S元素的化合价升高,则二氧化硫被氧化作还原剂,体现还原性;所以答案是:I2+SO2+2H2O=2HI+H2SO4;还原;(3)二氧化硫和水、碘单质发生本生反应生成硫酸、氢碘酸,碘化氢分解生成碘和氢气,所以该反应释放的能源气体为氢气;所以答案是:H2;(4)①Fe(NO3)3和Cu(NO3)2混合溶液中加入一定量KOH溶液反应生成CuFe2O4和KNO3 , 其反应的方程式为:2Fe(NO3)3+Cu(NO3)2+8KOH=CuFe2O4+8KNO3+4H2O;所以答案是:2Fe(NO3)3+Cu(NO3)2+8KOH=CuFe2O4+8KNO3+4H2O;②设CuFe2O3.86中Fe3+个数为x,Fe2+的个数为y,
;(2)反应①为二氧化硫与单质碘反应生成HI和硫酸,其反应的方程式为:I2+SO2+2H2O=2HI+H2SO4;反应中S元素的化合价升高,则二氧化硫被氧化作还原剂,体现还原性;所以答案是:I2+SO2+2H2O=2HI+H2SO4;还原;(3)二氧化硫和水、碘单质发生本生反应生成硫酸、氢碘酸,碘化氢分解生成碘和氢气,所以该反应释放的能源气体为氢气;所以答案是:H2;(4)①Fe(NO3)3和Cu(NO3)2混合溶液中加入一定量KOH溶液反应生成CuFe2O4和KNO3 , 其反应的方程式为:2Fe(NO3)3+Cu(NO3)2+8KOH=CuFe2O4+8KNO3+4H2O;所以答案是:2Fe(NO3)3+Cu(NO3)2+8KOH=CuFe2O4+8KNO3+4H2O;②设CuFe2O3.86中Fe3+个数为x,Fe2+的个数为y,
由化合价的代数和为零得:2+3x+2y+(﹣2)×3.86=0,x+y=2,则解得: ![]() =43:7,所以CuFe2O3.86中Fe3+与Fe2+的质量百分含量之比为 43:7;所以答案是:43:7;(5)电解时二氧化硫在阳极失电子生成硫酸,其电极方程式为:SO2+2H2O﹣2e﹣=4H++SO42﹣;碘单质在N极得电子生成碘离子,M极附近产生的H+通过质子交换膜移动到N极附近,碘离子与氢离子结合形成HI;所以答案是:SO2+2H2O﹣2e﹣=4H++SO42﹣;M极附近产生的H+通过质子交换膜移动到N极附近,与I2失电子后得到的I﹣形成HI溶液.
=43:7,所以CuFe2O3.86中Fe3+与Fe2+的质量百分含量之比为 43:7;所以答案是:43:7;(5)电解时二氧化硫在阳极失电子生成硫酸,其电极方程式为:SO2+2H2O﹣2e﹣=4H++SO42﹣;碘单质在N极得电子生成碘离子,M极附近产生的H+通过质子交换膜移动到N极附近,碘离子与氢离子结合形成HI;所以答案是:SO2+2H2O﹣2e﹣=4H++SO42﹣;M极附近产生的H+通过质子交换膜移动到N极附近,与I2失电子后得到的I﹣形成HI溶液.


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
【题目】将氯气用导管通入较浓的NaOH和H2O2的混和液中,在导管口与混和液的接触处有闪烁的红光出现.这是因为通气后混和液中产生的ClO﹣被H2O2还原,发生激烈反应,产生能量较高的氧分子,然后立即转变为普通氧分子,多余的能量以红光放出.本实验所用的仪器及导管如图1所示. 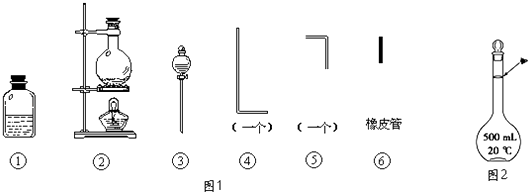
根据要求填写下列空白:
(1)组装氯气发生装置时,应选用的仪器及导管为(填写图中编号).
(2)本实验进行时,按气流方向从左到右的顺序,气体流经的各仪器及导管的编号依次为 .
(3)仪器①的橡皮塞上至少应有2个孔的原因是 .
(4)本实验需配置10molL﹣1的NaOH溶液500mL,用到的仪器除了托盘天平、烧杯外,还须用到的仪器有(填仪器名称),定容时操作如图2,则所配溶液浓度(填“偏高”或“偏低”).
(5)实验时仪器①中ClO﹣与H2O2反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识,完成题目:
(1)请写出下列反应对应的离子方程式: ①用盐酸中和氢氧化钠溶液: .
②用稀硫酸清洗铁锈(Fe2O3):;
(2)写出离子反应方程式所对应的一个化学方程式.①Ba2++2OH﹣+SO ![]() +2H+=BaSO4↓+2H2O
+2H+=BaSO4↓+2H2O
②CO ![]() +2H+=H2O+CO2↑ .
+2H+=H2O+CO2↑ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察如下反应,总结规律,然后完成下列问题:①Al(OH)3+H2OAl(OH) ![]() +H+;
+H+;
②NH3+H2ONH ![]() +OH﹣
+OH﹣
(A)已知B(OH)3是一元弱酸,试写出其电离方程式________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)0.4mol氨气和0.2mol硫化氢的质量之比为 , 所含分子数之比为 .
(2)现有NH3、H2S、HCl三种气体,它们分别都含有1mol氢原子,则三种气体的物质的量之比为 .
(3)以下物质:①碳酸钾 ②空气 ③二氧化碳 ④铜 ⑤食盐 ⑥氢氧化钠 ⑦硫酸铜溶液 ⑧酒精 ⑨蔗糖(C12H22O11).其中属于电解质的是(填序号).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备1,2﹣二溴乙烷的反应原理如下: CH3CH2OH ![]() CH2═CH2
CH2═CH2
CH2═CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2﹣二溴乙烷的装置如图所示:
有关数据列表如下:
乙醇 | 1,2﹣二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/gcm﹣3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | 一l30 | 9 | ﹣1l6 |
回答下列问题:
(1)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是;(填正确选项前的字母) a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入 , 其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母) a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是;
(4)将1,2﹣二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在层(填“上”、“下”);
(5)若产物中有少量未反应的Br2 , 最好用洗涤除去;(填正确选项前的字母) a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚.可用的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是;但又不能过度冷却(如用冰水),其原因是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应对应的离子方程式表示正确的是( )
A.FeCl3溶液与Cu的反应:Cu+Fe3+═Cu2++Fe2+
B.NH4HCO3溶于过量的NaOH溶液中:HCO ![]() +OH﹣═
+OH﹣═ ![]() +H2O
+H2O
C.少量SO2通入苯酚钠溶液中:C6H5O﹣+SO2+H2O═C6H5OH+HSO ![]()
D.FeBr2溶液与等物质的量的Cl2反应:2Fe2++2Br﹣+2Cl2═2Fe3++4Cl﹣+Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在日常生活中,我们经常看到铁制品生锈、铝制品表面出现白斑等众多的金属腐蚀现象.可以通过下列装置所示实验进行探究.下列说法正确的是( ) 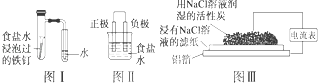
A.按图Ⅰ装置实验,为了更快更清晰地观察到液柱上升,可采用下列方法:用酒精灯加热具支试管
B.图Ⅱ是图Ⅰ所示装置的原理示意图,图Ⅱ的正极材料是铁
C.铝制品表面出现白斑可以通过图Ⅲ装置进行探究,Cl﹣由活性炭区向铝箔表面区迁移,并发生电极反应:2Cl﹣﹣2e﹣═Cl2↑
D.图Ⅲ装置的总反应为4Al+3O2+6H2O═4Al(OH)3 , 生成的Al(OH)3进一步脱水形成白斑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中.下列分析正确的是( ) 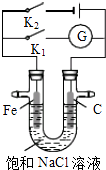
A.K1闭合,铁棒上发生的反应为2H++2e﹣→H2↑
B.K1闭合,石墨棒周围溶液pH逐渐降低
C.K2闭合,铁棒不会被腐蚀,属于外加电流的阴极保护法
D.K2闭合,电路中通过0.4NA个电子时,两极共产生4.48L气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com