
����Ŀ���������õ���ͨ���Ũ��NaOH��H2O2�Ļ��Һ�У��ڵ��ܿ�����Һ�ĽӴ�������˸�ĺ����֣�������Ϊͨ������Һ�в�����ClO����H2O2��ԭ���������ҷ�Ӧ�����������ϸߵ������ӣ�Ȼ������ת��Ϊ��ͨ�����ӣ�����������Ժ��ų�����ʵ�����õ�������������ͼ1��ʾ�� 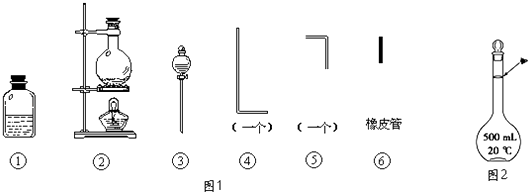
����Ҫ����д���пհף�
��1����װ��������װ��ʱ��Ӧѡ�õ�����������Ϊ����дͼ�б�ţ���
��2����ʵ�����ʱ����������������ҵ�˳�����������ĸ����������ܵı������Ϊ ��
��3�������ٵ���Ƥ��������Ӧ��2����ԭ���� ��
��4����ʵ��������10molL��1��NaOH��Һ500mL���õ�����������������ƽ���ձ��⣬�����õ��������������������ƣ�������ʱ������ͼ2����������ҺŨ�����ƫ�ߡ���ƫ�͡�����
��5��ʵ��ʱ��������ClO����H2O2��Ӧ�����ӷ���ʽΪ ��
���𰸡�
��1���ۢڢ�
��2���ڢݢޢܢ�
��3��ʹƿ����ѹǿ���
��4��500mL����ƿ������������ͷ�ιܣ�ƫ��
��5��ClO��+H2O2=Cl��+O2��+H2O
���������⣺��1�����ڷ�Ӧ���Ƕ������̺�Ũ���ᣬ�����ڷ�Ӧǰ���߲��ܻ�ϣ��÷�Һ©����װŨ���ᣬ��Ҫ�ڢ�װ�ã���Ӧ�����Ǽ��ȣ���Ҫ�ڢڸ�װ�ã�����Ҫ�õ��ܵ��������������õ��ݣ�
���Դ��ǣ��ۢڢݣ���2���ڢ��еij������ǽ���������������ڢٸ�װ�õģ�������Ҫ����Ƥ�ܽ���������̵��������������������������ĸ����������ܵı�������Ǣڢݢޢܢ٣�
���Դ��ǣ��ڢݢޢܢ٣���3������ƿ�ڲ�����������ʹƿ��ѹǿ����������Ƥ���Ŀ�������ը����С����Ϊ��ʹƿ����ѹǿ��ȣ�
���Դ��ǣ�ʹƿ����ѹǿ��ȣ���4������10molL��1��NaOH��Һ500mL����������Ϊ500mL����ƿ������������ͷ�ιܣ�����ʱ����ˮ��ˮƫ�٣���Һ���ƫС����c= ![]() ��֪��Ũ��ƫ�ߣ�
��֪��Ũ��ƫ�ߣ�
���Դ��ǣ�500mL����ƿ������������ͷ�ιܣ�ƫ�ߣ���6���������������ǿ�����ԣ�˫��ˮ�л�ԭ�ԣ����Դ���������Ӻ�˫��ˮ����������ԭ��Ӧ���������ӡ�������ˮ���������ӷ���ʽΪClO��+H2O2=Cl��+O2��+H2O�����Դ��ǣ�ClO��+H2O2=Cl��+O2��+H2O��
�����㾫����������Ҫ�����������Ļ�ѧ���ʺ�������ʵ�����Ʒ������֪ʶ�㣬��Ҫ���������Ļ�ѧ���ʣ��������Ӧ�����������ɸ�̬���ǽ�����Ӧ����ˮ��Ӧ����Ӧ���뻹ԭ�����ʷ�Ӧ��ʵ�����Ʒ���MnO2+4HCl��Ũ��=MnCl2+Cl2��+2H2O������ȷ�����⣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Na2SO3��Һ�������Ṥҵβ���еĶ����������õĻ��Һ���е��ѭ�������������¹��ս�����ѭ�������������������ӽ���Ĥ���ѭ��������������ͼ��ʾ���������й�˵���в���ȷ����
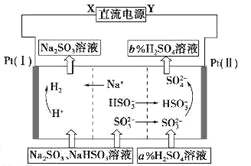
A. XΪֱ����Դ�ĸ�����YΪֱ����Դ������
B. ������pH����
C. ͼ�е�b>a
D. �ù����еIJ�Ʒ��ҪΪH2SO4��H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д��ȷ���ǣ� ��
A.����ϡ���2Fe+6H+�T2Fe3++3H2��
B.̼�������ϡ���HCO ![]() +H+�TH2O+CO2��
+H+�TH2O+CO2��
C.�����Ȼ�ͭ��Һ��Ӧ��Al+Cu2+�TAl3++Cu
D.�����������O2��+2H+�TH2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ���������ֵ������˵����ȷ���ǣ� ��
A.��״���£�22.4LCCl4����NA������
B.0.1molAlCl3��ȫת��Ϊ���壬���ɽ������ӵ���ĿΪ0��l NA��
C.���³�ѹ��46gNO2��N2O4�Ļ�����庬��3NA��ԭ��
D.0.1molCl2���������NaOH��Һ��Ӧ��ת�Ƶ�����Ϊ0.2 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������������˫��Ĥ���ҵ��۴�����ˮ�е�NH4+,ģ��װ����ͼ��ʾ������˵����ȷ���ǣ� ��
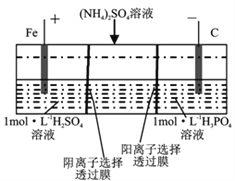
A. ��������Һ����ɫ����ػ�ɫ
B. �����ĵ缫��ӦʽΪ��4OH--4e-=2H2O+O2��
C. ���һ��ʱ�����������Һ�е�pH����
D. ���һ��ʱ�����������Һ�е�����һ����(NH4)3PO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ĸ������У���ԭ��������С������ȷ���ǣ� �� ��2.24L HCl����״���� ��3.01��1023 ���������� ��27g H2O ��0.5mol H2SO4 ��
A.�٢ڢۢ�
B.�ܢ٢ۢ�
C.�ۢܢڢ�
D.�ܢۢ٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йذ����ӵ�����(NA)��˵������ȷ����
A. 0.012 kg12C�����е�̼ԭ����ΪNA��
B. NA�Ľ���ֵΪ6.02��1023
C. 1 mol H2O���е�H2O������ĿΪNA��
D. NA��Cl2������Ϊ35.5 g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��̽��һ����������������������֮����ת������ͬѧ���������ʵ�飺��ͼ������ͭƬװ��С�Թ��У��ټ�������ϡ���ᣬȻ��Ѹ�ٽ����Թܵ�����С�Թ��⣮���õĴ�С�Թ�һ���������ձ��У�ʹˮ��û���Թܿڣ���ַ�Ӧ���ͨ���䲣���������Թ��д������������������ձ��е��˼�����ɫʯ����Һ���Իش�
��1��д��ͭƬ����ϡ��������ӷ���ʽ
��2���������ǰС�Թ��е�������ͭƬ���ܽ⣮��Һ����ɫ��
��3������С�Թ��м����� 0.192gͭƬ��5mlŨ��Ϊ2mol/L��ϡ���ᣬ���ַ�Ӧ��С�Թ����� Һ��NO ![]() ���ʵ���Ũ��Ϊmol/L��������Һ����仯����
���ʵ���Ũ��Ϊmol/L��������Һ����仯����
��4������ˮ��������������Һ��ʵ����������ɵ�һ�ֺ���ɫ���������������Ӧ�������������κ�ˮ�������������뻹ԭ��������ʵ�����ȣ���д���÷�Ӧ�����ӷ���ʽ
��5�����������ͭƬ�ֱ�������������Ũ��ϡ���ᷴӦ��������Һ������� ������Һǰ�߳���ɫ�����߳���ɫ��ijͬѧ��Ϊ������Cu2Ũ�ȵIJ�������ģ�����Ϊ�Ƿ���ȷ�������ȷ������ȷ������������ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧѭ��ԭ����ͼ1��ʾ��
��1��д����Ӧ�۵Ļ�ѧ����ʽ �� һ���¶��£���2L�ܱ������м���2mol HI��g�������n ��H2����ʱ��ı仯��ͼ2��ʾ������¶��¸÷�Ӧ��ƽ�ⳣ��K= ��
��2��д����Ӧ�ٵĻ�ѧ����ʽ �� ����SO2���ֵ����ԣ�
��3���ۺϢ٢ڢ�������Ӧ���ɿ����û�ѧѭ����Ϊ���Ʊ�ij����Դ���壬������Ļ�ѧʽ�� ��
��4����ȱλ����ͭ��CuFe2O4�������Ƿ�Ӧ�ڵ����õĴ�����ʵ���������·����Ƶã�����Fe��NO3��3��Cu��NO3��2�����Һ�м���һ����KOH��Һ������
����pH����������24Сʱ
���ˡ�����������ͭ��CuFe2O4��
�����ڵ��������¡�1223Kʱ����CuFe2O4 �� �õ�CuFe2O3.86
��д���Ʊ��õ�CuFe2O4�Ļ�ѧ����ʽ
���о����֣�
�¶� | Ԫ�ش�����ʽ |
1200��1350K | Fe3+����ת��ΪFe2+ |
����CuFe2O3.86��Fe3+��Fe2+�������ٷֺ���֮��Ϊ ��
��5�����ڸ�ѭ����H2SO4��HI��������Ӧ��ɷ�Ӧ������������п�ѧ������ͼ3��ʾԭ�����з�Ӧ��д�������ĵ缫��Ӧʽ �� ��������˵����N���ܹ�����������ʵ�ԭ���� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com