
【题目】下列化学反应对应的离子方程式表示正确的是( )
A.FeCl3溶液与Cu的反应:Cu+Fe3+═Cu2++Fe2+
B.NH4HCO3溶于过量的NaOH溶液中:HCO ![]() +OH﹣═
+OH﹣═ ![]() +H2O
+H2O
C.少量SO2通入苯酚钠溶液中:C6H5O﹣+SO2+H2O═C6H5OH+HSO ![]()
D.FeBr2溶液与等物质的量的Cl2反应:2Fe2++2Br﹣+2Cl2═2Fe3++4Cl﹣+Br2
科目:高中化学 来源: 题型:
【题目】下列有关阿伏加德罗常数(NA)的说法不正确的是
A. 0.012 kg12C所含有的碳原子数为NA个
B. NA的近似值为6.02×1023
C. 1 mol H2O含有的H2O分子数目为NA个
D. NA个Cl2的质量为35.5 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解一定量的硫酸铜溶液,电解一段时间后,向电解液加入0.1mol碱式碳酸铜晶体(不含结晶水),恰好使溶液恢复到电解前的浓度和pH.下列有关叙述不正确的是( )
A.电解过程产生的气体体积(在标准状况下)为5.6 L
B.电解过程只发生了2CuSO4+2H2O ![]() 2Cu+O2↑+2H2SO4
2Cu+O2↑+2H2SO4
C.电解过程转移的电子数为3.612×1023个
D.加入的碱式碳酸铜的反应是:Cu2(OH)2CO3+2H2SO4═2CuSO4+CO2↑+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘硫化学循环原理如图1所示.
(1)写出反应③的化学方程式 , 一定温度下,向2L密闭容器中加入2mol HI(g),测得n (H2)随时间的变化如图2所示,则该温度下该反应的平衡常数K= .
(2)写出反应①的化学方程式 , 其中SO2体现的是性.
(3)综合①②③三个反应,可看出该化学循环是为了制备某种能源气体,该气体的化学式是 .
(4)氧缺位铁酸铜(CuFe2O4﹣δ)是反应②的良好的催化剂.实验室用如下方法制得:Ⅰ.在Fe(NO3)3和Cu(NO3)2混合溶液中加入一定量KOH溶液,加热
Ⅱ.调节pH并连续搅拌24小时
Ⅲ.过滤、干燥获得铁酸铜(CuFe2O4)
Ⅳ.在氮气保护下、1223K时煅烧CuFe2O4 , 得到CuFe2O3.86
①写出制备得到CuFe2O4的化学方程式
②研究发现:
温度 | 元素存在形式 |
1200﹣1350K | Fe3+部分转变为Fe2+ |
计算CuFe2O3.86中Fe3+与Fe2+的质量百分含量之比为 .
(5)由于该循环中H2SO4与HI发生副反应造成反应器堵塞,因此有科学家用如图3所示原理进行反应.写出阳极的电极反应式 . 请用文字说明在N极能够获得所需物质的原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色化学是“预防污染”的根本手段,它的目标是研究和寻找能充分利用的无毒害原材料,最大限度地节约能源,在化工生产各个环节中都实现净化和无污染.
(1)下列各项符合“绿色化学”要求的是 .
A.处理废弃物
B.治理污染点
C.减少有毒物
D.杜绝污染源
(2)在我国西部大开发中,某地为筹建一大型化工基地,征集到下列方案,其中你认为可行的是 .
A.建在西部干旱区可以脱贫致富
B.应建在水资源丰富和交通方便且远离城市的郊区
C.企业有权自主选择厂址
D.不宜建在人口稠密的居民区
(3)某化工厂排放的污水中含有Mg2+、Fe3+、Cu2+、Hg2+四种离子.某同学设计了从该污水中回收纯净的金属铜的方案.
在能制得纯铜的方案中,哪一步操作会导致环境污染? . 应增加哪些措施防止污染 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,而辛是由C元素形成的单质.已知:甲+乙=丁+辛,甲+丙=戊+辛;常温下0.1mol/L丁溶液的pH为13,则下列说法正确的是( )
A.元素C形成的单质可以在点燃条件分别与元素A、B、D形成的单质化合,所得化合物均存在共价键
B.元素B、C、D的原子半径由大到小的顺序为:r(D)>r(C)>r(B)
C.1.0 L 0.1 mol/L戊溶液中含阴离子总的物质的量小于0.1 mol
D.1 mol甲与足量的乙完全反应共转移约1.204×1024个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.
(1)写出溴乙烷在NaOH水溶液中的反应方程式:反应类型 . 某同学取少量溴乙烷与NaOH水溶液反应后的混合溶液,向其中滴加AgNO3 溶液,加热,产生少量沉淀.该同学由此得出溴乙烷与NaOH水溶液反应,生成了溴化钠,你认为是否合理,原因: .
(2)写出溴乙烷在NaOH乙醇溶液中的反应方程式反应类型 . 反应中生成的气体可以用上图所示装置检验,现象是 , 水的作用是 . 除高锰酸钾酸性溶液外,还可以用检验生成的气体,此时还有必要将气体先通入水中吗?(填“有”或“没有”)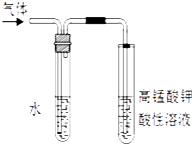
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是( )
A.向稀HNO3中滴加Na2SO3溶液SO ![]() +2H+═SO2↑+H2O
+2H+═SO2↑+H2O
B.CuSO4溶液与H2S反应的离子方程式:Cu2++S2﹣═CuS↓
C.氯气溶于水:Cl2+H2═2H++Cl﹣+ClO﹣
D.向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2═4Na++2Cu(OH)2↓+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一容积不变的密闭容器中,A(g)+2B(g)3C(g)达到平衡时,A.B和C的物质的量分别为3mol、2mol和4mol,若温度不变,向容器内的平衡混合物中再加入A、C各lmol,此时该平衡移动的方向为( )
A.向左移动
B.向右移动
C.不移动
D.无法判断
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com