
【题目】用下图所示装置进行第二组实验。实验过程中,观察到与第一组实验不同的现象:两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。 查阅资料得知,高铁酸根离子(FeO42—)在溶液中呈紫红色。

(1)电解过程中,X 极区溶液的 pH__(填“增大”“减小”或“不变”)。
(2)电解过程中,Y 极发生的电极反应之一为 Fe﹣6e﹣+8OH﹣=FeO42—+4H2O 若在 X 极收集到672 mL 气体,在 Y 极收集到 168 mL 气体(均已折算为标准状况时气体体积),则 Y 电极(铁电极)质量减少__g。
(3)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为 2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的反应的电极反应式为________。
【答案】增大 0.28 2FeO42—+6e﹣+5H2O=Fe2O3+10OH﹣
【解析】
(1)根据电源的正负极判断电解池的阴阳极,进而分析电极反应,判断电极附近溶液的酸碱性;
(2)根据电解反应中,得失电子守恒列等式计算;
(3)根据总反应中元素化合价变化,分析正极反应式。
(1)电解过程中,X极连接电源负极,作阴极,阴极上氢离子放电生成氢气,氢离子浓度较小,所以溶液的pH增大,故答案为:增大;
(2)X电极上析出的是氢气,Y电极上析出的是氧气,且Y电极失电子进入溶液,设铁质量减少为xg,根据转移电子数相等得:![]() =
=![]() +
+![]() ,解得x=0.28,故答案为:0.28;
,解得x=0.28,故答案为:0.28;
(3)根据总反应知,正极上高铁酸根离子得电子发生还原反应,电极反应式为 2FeO42—+6e﹣+5H2O=Fe2O3+10OH﹣,故答案为: 2FeO42—+6e﹣+5H2O=Fe2O3+10OH﹣。


 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
【题目】将金属M的样品2.5g放入50g 19.6%的硫酸溶液中,恰好完全反应(样品中的杂质既不溶于硫酸,也不与其发生反应),生成硫酸盐。实验测知,此硫酸盐中硫、氧元素的质量分数之和为80 %。试求:
(1)原金属样品中,金属M的质量分数_____
(2)M的相对原子质量__________
(3)反应所得的硫酸盐溶液中溶质的质量分数___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 蛋白质、纤维素、蔗糖、![]() 、淀粉都是高分子化合物
、淀粉都是高分子化合物
B. 蔗糖在人体内水解的产物只有葡萄糖
C. 使用太阳能热水器、沼气的利用、玉米制乙醇都涉及到生物质能的利用
D. 石油、煤、天然气、可燃冰都是化石燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工生产中常用FeS作为沉淀剂除去工业废水中的Pb2+,反应原理为FeS(s)+Pb2+(aq) ![]() PbS(s)+Fe2+(aq),下列有关叙述错误的是( )
PbS(s)+Fe2+(aq),下列有关叙述错误的是( )
A.达到平衡时,c(Pb2+)=c(Fe2+)
B.Ksp(FeS)大于Ksp(PbS)
C.该反应的平衡常数K=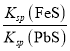
D.溶液中加入少量Na2S固体后,c(Fe2+)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1mol/L CH3COOH溶液加入水稀释或加入少量CH3COONa晶体时,都会引起
A. 溶液中pH增大B. CH3COOH的电离程度变大
C. 溶液的导电能力减弱D. CH3COO-的浓度变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锶(Sr)元素广泛存在于矿泉水中,是一种人体必需的微量元素,在元素周期表中与钙和钡属于第ⅡA族元素。
(1)碱性:Sr(OH)2___Ba(OH)2(填“<”或“>”;锶的化学性质与钙和钡类似,用原子结构的观点解释其原因是___。
(2)碳酸锶是最重要的锶化合物。用含SrSO4和少量BaSO4、BaCO3、FeO、Fe2O3、Al2O3、SiO2的天青石制备SrCO3,工艺流程如下(部分操作和条件略):
Ⅰ.将天青石矿粉和碳酸钠溶液混合后充分反应,过滤;
Ⅱ.向滤渣中加入足量盐酸充分反应,过滤;
Ⅲ.向Ⅱ所得滤液中加入足量的稀硫酸,过滤;
Ⅳ.向Ⅲ所得滤液中先加入氯水,充分反应后再用氨水调pH约为7,过滤;
Ⅴ.向Ⅳ所得滤液中加入稍过量的碳酸氢铵溶液,充分反应后过滤,将沉淀洗净,烘干,得SrSO3。
已知:ⅰ.相同温度时溶解度:BaSO4<SrCO3<SrSO4<CaSO4
ⅱ.生成氢氧化物沉淀的pH如下表所示:
物质 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀的pH | 1.9 | 7.0 | 3.4 |
完全沉淀的pH | 3.2 | 9.0 | 4.7 |
①步骤Ⅰ中,反应的化学方程式是______。为提高此步骤中锶的转化效果可以采取的措施有(任答两点即可):______。
②步骤Ⅱ中,能与盐酸反应而溶解的物质有______。
③步骤Ⅳ的目的是_______。
④下列关于该工艺流程的说法正确的是________(填字母代号)。
a.该工艺产生的废液含较多的NH4+、Na+、SO42-、Cl-
b.SiO2在步骤Ⅰ操作时被过滤除去
c.步骤Ⅴ中反应时,加入NaOH溶液可以提高NH4HCO3的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种碳纳米管能够吸附氢气,用这种材料制备的电池其原理如图所示,该电池的电解质为6mol·L-1KOH溶液。下列说法中不正确的是( )

A.放电时镍电极作负极
B.放电时K+移向正极
C.放电时碳电极的电极反应为H2-2e-+2OH-=2H2O
D.该反应过程中KOH溶液的浓度基本保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,几种常见弱酸的Ka如下表所示[已知草酸(H2C2O4)是一种二元弱酸]:
弱酸 | H2C2O4 | CH3COOH | HCN | H2CO3 |
Ka | K1=5.6×10-2 K2=5.4×10-5 | 1.8×10-5 | 6.2×10-10 | K1=4.2×10-7 K2=5.6×10-11 |
(1)25 ℃时,0.1 mol·L-1的Na2C2O4、CH3COONa、NaCN、Na2CO3溶液的pH由大到小的顺序是________________________,中和等体积等pH的CH3COOH和HCN溶液消耗NaOH的物质的量________(填“前者大”或“后者大”)。
(2)KHC2O4溶液呈酸性。向10 mL 0.01 mol·L-1的H2C2O4溶液滴加0.01 mol·L-1KOH溶液V(mL),回答下列问题:
①当V<10 mL时,反应的离子方程式为________________________________。
②当V=10 mL时,溶液中HC2O![]() 、C2O
、C2O![]() 、H2C2O4、H+的浓度从大到小的顺序为_____________________。
、H2C2O4、H+的浓度从大到小的顺序为_____________________。
③当V=amL时,溶液中离子浓度有如下关系:c(K+)=2c(C2O![]() )+c(HC2O
)+c(HC2O![]() );当V=bmL时,溶液中离子浓度有如下关系:c(K+)=c(C2O
);当V=bmL时,溶液中离子浓度有如下关系:c(K+)=c(C2O![]() )+c(HC2O
)+c(HC2O![]() )+c(H2C2O4);则a________(填“<”“=”或“>”)b。
)+c(H2C2O4);则a________(填“<”“=”或“>”)b。
④当V=20 mL时,再滴入NaOH溶液,则溶液中n(K+)/n(C2O![]() )的值将________(
)的值将________(
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用重铬酸钠(Na2Cr2O7)结晶后的母液(含少量杂质Fe3+)生产重铬酸钾(K2Cr2O7),工艺流程及相关物质溶解度曲线如图:


(1)由Na2Cr2O7生产K2Cr2O7的化学方程式为________________。
(2)由图分析选择冷却结晶的原因是_______________。
(3)向Na2Cr2O7母液中加碱液调pH的目的是_____________。
(4)分离得到固体A的方式为______,用热水洗涤固体A,回收的洗涤液转移到母液____(填“Ⅰ”“Ⅱ”或“Ⅲ”)中,既能提高产率又可使能耗最低。
(5)生产工艺中含Cr2O72-的废水常用于处理废水中的CN-,处理过程按下图流程进行:

步骤③中,每处理0.3 mol Cr2O72-时转移电子1.8 mol,该反应的离子方程式为________;
②处理酸性Cr2O72-废水多采用铁氧磁体法。该法是向废水中加入FeSO4·7H2O将Cr2O72-还原成Cr3+,调节pH,Fe、Cr转化成相当于Feπ[FexIIICr(2-x)III]O4 (铁氧磁体,罗马数字表示元素价态)的沉淀。处理1 mol Cr2O72-,需加入a mol FeSO4·7H2O,下列结论正确的是_______。
A.x=0.5,a=6 B.x=0.5,a=10
C.x=1.5,a=6 D.x=1.5,a=10
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com