
ЁОЬтФПЁП25 ЁцЪБЃЌМИжжГЃМћШѕЫсЕФKaШчЯТБэЫљЪО[вбжЊВнЫс(H2C2O4)ЪЧвЛжжЖўдЊШѕЫс]ЃК
ШѕЫс | H2C2O4 | CH3COOH | HCN | H2CO3 |
Ka | K1=5.6ЁС10Ѓ2 K2=5.4ЁС10Ѓ5 | 1.8ЁС10Ѓ5 | 6.2ЁС10Ѓ10 | K1=4.2ЁС10Ѓ7 K2=5.6ЁС10Ѓ11 |
ЃЈ1ЃЉ25 ЁцЪБЃЌ0.1 molЁЄLЃ1ЕФNa2C2O4ЁЂCH3COONaЁЂNaCNЁЂNa2CO3ШмвКЕФpHгЩДѓЕНаЁЕФЫГађЪЧ________________________ЃЌжаКЭЕШЬхЛ§ЕШpHЕФCH3COOHКЭHCNШмвКЯћКФNaOHЕФЮяжЪЕФСП________(ЬюЁАЧАепДѓЁБЛђЁАКѓепДѓЁБ)ЁЃ
ЃЈ2ЃЉKHC2O4ШмвКГЪЫсадЁЃЯђ10 mL 0.01 molЁЄLЃ1ЕФH2C2O4ШмвКЕЮМг0.01 molЁЄLЃ1KOHШмвКV(mL)ЃЌЛиД№ЯТСаЮЪЬтЃК
ЂйЕБV<10 mLЪБЃЌЗДгІЕФРызгЗНГЬЪНЮЊ________________________________ЁЃ
ЂкЕБVЃН10 mLЪБЃЌШмвКжаHC2O![]() ЁЂC2O
ЁЂC2O![]() ЁЂH2C2O4ЁЂHЃЋЕФХЈЖШДгДѓЕНаЁЕФЫГађЮЊ_____________________ЁЃ
ЁЂH2C2O4ЁЂHЃЋЕФХЈЖШДгДѓЕНаЁЕФЫГађЮЊ_____________________ЁЃ
ЂлЕБVЃНamLЪБЃЌШмвКжаРызгХЈЖШгаШчЯТЙиЯЕЃКc(KЃЋ)ЃН2c(C2O![]() )ЃЋc(HC2O
)ЃЋc(HC2O![]() )ЃЛЕБVЃНbmLЪБЃЌШмвКжаРызгХЈЖШгаШчЯТЙиЯЕЃКc(KЃЋ)ЃНc(C2O
)ЃЛЕБVЃНbmLЪБЃЌШмвКжаРызгХЈЖШгаШчЯТЙиЯЕЃКc(KЃЋ)ЃНc(C2O![]() )ЃЋc(HC2O
)ЃЋc(HC2O![]() )ЃЋc(H2C2O4)ЃЛдђa________(ЬюЁАЃМЁБЁАЃНЁБЛђЁАЃОЁБ)bЁЃ
)ЃЋc(H2C2O4)ЃЛдђa________(ЬюЁАЃМЁБЁАЃНЁБЛђЁАЃОЁБ)bЁЃ
ЂмЕБVЃН20 mLЪБЃЌдйЕЮШыNaOHШмвКЃЌдђШмвКжаn(KЃЋ)/n(C2O![]() )ЕФжЕНЋ________(
)ЕФжЕНЋ________(
ЁОД№АИЁПNa2CO3>NaCN>CH3COONa>Na2C2O4 КѓепДѓ H2C2O4ЃЋOHЃ=== HCO4ЃЃЋH2O c(HCO4Ѓ)ЃОc(HЃЋ)ЃОc(C2O42Ѓ)ЃОc(H2C2O4) ЃО БфаЁ
ЁОНтЮіЁП
(1)ШѕЫсЕФKaдНаЁЃЌШѕЫсИљРызгЫЎНтГЬЖШдНДѓЃЌШмвКжаc(OHЃ)дНДѓЃЛгЩгкKa(CH3COOH)>Ka(HCN)ЃЌЕШЬхЛ§ЕШpHЕФCH3COOHШмвККЭHCNШмвКжаn(HCN)>n(CH3COOH)ЃЛ
(2)ИљОнЬтвтHC2O4ЃЕФЕчРыГЬЖШДѓгкЦфЫЎНтГЬЖШЃЛ
ЂйЕБVЃМ10 mLЃЌH2C2O4гыOHЃЗДгІЩњГЩHC2O4ЃКЭH2OЃЛ
ЂкЕБVЃН10 mLЪБЃЌе§КУЩњГЩKHC2O4ШмвКЃЌгЩгкHC2OЕФЕчРыГЬЖШДѓгкЦфЫЎНтГЬЖШЃЛ
ЂлЕБc(KЃЋ)ЃН2c(C2O42Ѓ)ЃЋc(HC2O4Ѓ)ЪБЃЌШмвКГЪжаадЃЌШєaЃН10 mLЃЌГЪЫсадЃЌГЪжаадЪБaЃО10 mLЃЛ
ЂмЕБVЃН20 mLЪБЃЌе§КУЩњГЩK2C2O4ШмвКЃЌC2O42ЃЃЋH2O![]() HC2O4ЃЃЋOHЃЃЌЕБЕЮШыNaOHШмвКЪБЃЌвжжЦC2O42ЃЫЎНтЁЃ
HC2O4ЃЃЋOHЃЃЌЕБЕЮШыNaOHШмвКЪБЃЌвжжЦC2O42ЃЫЎНтЁЃ
(1)ЕчРыГЃЪ§дНДѓЃЌЫсЕФЫсаддНЧПЃЌЦфбЮШмвКЕФЫЎНтГЬЖШдНаЁЃЌбЮШмвКЕФpHдНаЁЃЌдђХЈЖШОљЮЊ0.1molL-1ЕФNa2C2O4ЁЂCH3COONaЁЂNaCNЁЂNa2CO3ЕФpHгЩДѓЕНаЁЕФЫГађЪЧNa2CO3ЃОNaCNЃОCH3COONaЃОNa2C2O4ЃЛpHЯрЭЌЪБЃЌЫсаддНЧПЃЌЦфЫсЕФХЈЖШдНаЁЃЌвбжЊМзЫсЕФЫсадДѓгкHCNЃЌдђpHЯрЭЌЪБHCNЕФХЈЖШДѓЃЌЫљвджаКЭЕШЬхЛ§ЁЂЕШpHЕФHCOOHКЭHCNЯћКФNaOHЕФСПЃЌHCNЯћКФЕФЧтбѕЛЏФЦЖрЃЛ
(2)ИљОнЬтвтHC2O4ЃЕФЕчРыГЬЖШДѓгкЦфЫЎНтГЬЖШЁЃ
ЂйЕБVЃМ10 mLЃЌH2C2O4гыOHЃЗДгІЩњГЩHC2O4ЃКЭH2OЃЌЗДгІЕФРызгЗНГЬЪНЮЊH2C2O4ЃЋOHЃ=== HCO4ЃЃЋH2OЃЛ
ЂкЕБVЃН10 mLЪБЃЌе§КУЩњГЩKHC2O4ШмвКЃЌгЩгкHC2OЕФЕчРыГЬЖШДѓгкЦфЫЎНтГЬЖШЃЌЫљвдc(HC2O4Ѓ)ЃОc(HЃЋ)ЃОc(C2O42Ѓ)ЃОc(H2C2O4)ЃЛ
ЂлЕБc(KЃЋ)ЃН2c(C2O42Ѓ)ЃЋc(HC2O4Ѓ)ЪБЃЌШмвКГЪжаадЃЌШєaЃН10 mLЃЌГЪЫсадЃЌГЪжаадЪБaЃО10 mLЃЌЕБc(KЃЋ)ЃНc(C2O42Ѓ)ЃЋc(HC2O4Ѓ)ЃЋc(H2C2O4)ЪБЃЌе§КУЩњГЩKHC2O4ШмвКЃЌДЫЪБbЃН10 mLЃЌЫљвдaЃОbЃЛ
ЂмЕБVЃН20 mLЪБЃЌе§КУЩњГЩK2C2O4ШмвКЃЌC2O42ЃЃЋH2O![]() HC2O4ЃЃЋOHЃЃЌЕБЕЮШыNaOHШмвКЪБЃЌвжжЦC2O42ЃЫЎНтЃЌЫљвд
HC2O4ЃЃЋOHЃЃЌЕБЕЮШыNaOHШмвКЪБЃЌвжжЦC2O42ЃЫЎНтЃЌЫљвд НЋБфаЁЁЃ
НЋБфаЁЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГаЃЛЏбЇаЫШЄаЁзщЬНОП![]() гы
гы![]() ШмвКЕФЗДгІЃЌЫљгУзАжУШчЯТЭМЫљЪО
ШмвКЕФЗДгІЃЌЫљгУзАжУШчЯТЭМЫљЪО![]() МаГжвЧЦївбТдШЅ
МаГжвЧЦївбТдШЅ![]() ЁЃ
ЁЃ
![]() ЪЕбщЪвХфжЦКЭБЃДц
ЪЕбщЪвХфжЦКЭБЃДц![]() ШмвКгІЕЮМгЩйаэ______гкЪдМСЦПжаЁЃ
ШмвКгІЕЮМгЩйаэ______гкЪдМСЦПжаЁЃ
![]() ЪЕбщЙ§ГЬжаашвЊХфжЦ
ЪЕбщЙ§ГЬжаашвЊХфжЦ![]()
![]() ШмвКЃЌЫљашвЊЕФВЃСЇвЧЦїгаЃКЩеБЁЂСПЭВЁЂВЃСЇАєЁЂНКЭЗЕЮЙмЁЂ______ЁЃ
ШмвКЃЌЫљашвЊЕФВЃСЇвЧЦїгаЃКЩеБЁЂСПЭВЁЂВЃСЇАєЁЂНКЭЗЕЮЙмЁЂ______ЁЃ
![]() ИУаЁзщЭЌбЇЯђ5mL
ИУаЁзщЭЌбЇЯђ5mL![]()
![]() ШмвКжаЭЈШызуСПЕФ
ШмвКжаЭЈШызуСПЕФ![]() ЃЌШмвКзюжеГЪЧГТЬЩЋЃЌдйДђПЊЗжвКТЉЖЗЛюШћЃЌж№ЕЮМгШыNaOHЯЁШмвКЃЌдђЪдЙмBжаВњЩњЕФЪЕбщЯжЯѓЪЧ______ЁЃ
ЃЌШмвКзюжеГЪЧГТЬЩЋЃЌдйДђПЊЗжвКТЉЖЗЛюШћЃЌж№ЕЮМгШыNaOHЯЁШмвКЃЌдђЪдЙмBжаВњЩњЕФЪЕбщЯжЯѓЪЧ______ЁЃ
![]() ИУаЁзщЭЌбЇдк
ИУаЁзщЭЌбЇдк![]() жаЪЕбщЪБЃЌЗЂЯжШмвКБфЮЊЧГТЬЩЋашвЊНЯГЄЪБМфЃЌдкДЫЦкМфЭЌбЇУЧЙлВьЕНЕФЯжЯѓЪЧШмвКгЩзиЛЦЩЋБфГЩКьзиЩЋЃЌУЛгаЙлВьЕНЖЁДяЖћЯжЯѓЃЌзюжеШмвКГЪЧГТЬЩЋЁЃ
жаЪЕбщЪБЃЌЗЂЯжШмвКБфЮЊЧГТЬЩЋашвЊНЯГЄЪБМфЃЌдкДЫЦкМфЭЌбЇУЧЙлВьЕНЕФЯжЯѓЪЧШмвКгЩзиЛЦЩЋБфГЩКьзиЩЋЃЌУЛгаЙлВьЕНЖЁДяЖћЯжЯѓЃЌзюжеШмвКГЪЧГТЬЩЋЁЃ
ЃЈВщдФзЪСЯЃЉ![]() РызгдкШмвКжаГЪКьзиЩЋЧвОпгаНЯЧПЕФЛЙдадЃЌФмБЛ
РызгдкШмвКжаГЪКьзиЩЋЧвОпгаНЯЧПЕФЛЙдадЃЌФмБЛ![]() бѕЛЏЮЊ
бѕЛЏЮЊ![]() гы
гы![]() ШмвКЗДгІЩњГЩКьзиЩЋ
ШмвКЗДгІЩњГЩКьзиЩЋ![]() РызгЕФРызгЗНГЬЪНЪЧ______ЃЛ
РызгЕФРызгЗНГЬЪНЪЧ______ЃЛ![]() гы
гы![]() дкШмвКжаЗДгІЕФРызгЗНГЬЪНЪЧ______ЁЃ
дкШмвКжаЗДгІЕФРызгЗНГЬЪНЪЧ______ЁЃ
![]() ЮЊСЫАВШЋЦ№МћЃЌЛЙПЩвддкAЁЂBзАжУжЎМфМгвЛИі______зАжУЁЃ
ЮЊСЫАВШЋЦ№МћЃЌЛЙПЩвддкAЁЂBзАжУжЎМфМгвЛИі______зАжУЁЃ

![]() ШєЪЕбщжагУ5mLвЛЖЈХЈЖШЕФХЈ
ШєЪЕбщжагУ5mLвЛЖЈХЈЖШЕФХЈ![]() гыЪЪСПCuЦЌГфЗжЗДгІЃЌЪЕбщНсЪјКѓЃЌВтЕУВњЩњ
гыЪЪСПCuЦЌГфЗжЗДгІЃЌЪЕбщНсЪјКѓЃЌВтЕУВњЩњ![]() ЕФЬхЛ§дкБъзМзДПіЯТЮЊ672mLЃЌЯђвбРфШДЕФAЪдЙмШмвКжаМгШы
ЕФЬхЛ§дкБъзМзДПіЯТЮЊ672mLЃЌЯђвбРфШДЕФAЪдЙмШмвКжаМгШы![]() ЕФNaOHШмвК30mLЪБЃЌЧЁКУЪЙ
ЕФNaOHШмвК30mLЪБЃЌЧЁКУЪЙ![]() ЭъШЋГСЕэЁЃдђЫљгУХЈ
ЭъШЋГСЕэЁЃдђЫљгУХЈ![]() ХЈЖШЮЊ______ЁЃ
ХЈЖШЮЊ______ЁЃ![]() КіТдЙ§ГЬжаШмвКЕФЬхЛ§БфЛЏ
КіТдЙ§ГЬжаШмвКЕФЬхЛ§БфЛЏ![]()
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгУЯТЭМЫљЪОзАжУНјааЕкЖўзщЪЕбщЁЃЪЕбщЙ§ГЬжаЃЌЙлВьЕНгыЕквЛзщЪЕбщВЛЭЌЕФЯжЯѓЃКСНМЋОљгаЦјЬхВњЩњЃЌYМЋЧјШмвКж№НЅБфГЩзЯКьЩЋЃЛЭЃжЙЪЕбщЃЌЬњЕчМЋУїЯдБфЯИЃЌЕчНтвКШдШЛГЮЧхЁЃ ВщдФзЪСЯЕУжЊЃЌИпЬњЫсИљРызгЃЈFeO42ЁЊЃЉдкШмвКжаГЪзЯКьЩЋЁЃ

ЃЈ1ЃЉЕчНтЙ§ГЬжаЃЌX МЋЧјШмвКЕФ pH__ЃЈЬюЁАдіДѓЁБЁАМѕаЁЁБЛђЁАВЛБфЁБЃЉЁЃ
ЃЈ2ЃЉЕчНтЙ§ГЬжаЃЌY МЋЗЂЩњЕФЕчМЋЗДгІжЎвЛЮЊ FeЉ6eЉ+8OHЉ=FeO42ЁЊ+4H2O Шєдк X МЋЪеМЏЕН672 mL ЦјЬхЃЌдк Y МЋЪеМЏЕН 168 mL ЦјЬхЃЈОљвбелЫуЮЊБъзМзДПіЪБЦјЬхЬхЛ§ЃЉЃЌдђ Y ЕчМЋЃЈЬњЕчМЋЃЉжЪСПМѕЩй__gЁЃ
ЃЈ3ЃЉдкМюадаПЕчГижаЃЌгУИпЬњЫсМизїЮЊе§МЋВФСЯЃЌЕчГиЗДгІЮЊ 2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2ЃЌИУЕчГие§МЋЗЂЩњЕФЗДгІЕФЕчМЋЗДгІЪНЮЊ________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГЮТЖШЯТЃЌЯрЭЌЬхЛ§ЁЂЯрЭЌpHЕФАБЫЎКЭЧтбѕЛЏФЦШмвКМгЫЎЯЁЪЭЪБЕФpHБфЛЏЧњЯпШчЭМЫљЪОЃЌЯТСаХаЖЯе§ШЗЕФЪЧ
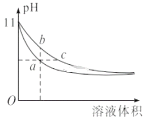
A. aЕуЕМЕчФмСІБШbЕуЧП
B. aЁЂcСНЕуЕФc(H+)ЯрЕШ
C. гыбЮЫсЭъШЋЗДгІЪБЃЌЯћКФбЮЫсЬхЛ§VaЃОVc
D. bЕуЕФKwжЕДѓгкcЕу
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПНёФъЪЧУХНнСаЗђЗЂЯждЊЫижмЦкТЩ150жмФъЁЃЯТБэЪЧдЊЫижмЦкБэЕФвЛВПЗжЃЌWЁЂXЁЂYЁЂZЮЊЖЬжмЦкжїзхдЊЫиЃЌWгыXЕФзюИпЛЏКЯМлжЎКЭЮЊ8ЁЃЯТСаЫЕЗЈДэЮѓЕФЪЧ

A. дзгАыОЖЃКW<X
B. ГЃЮТГЃбЙЯТЃЌYЕЅжЪЮЊЙЬЬЌ
C. ЦјЬЌЧтЛЏЮяШШЮШЖЈадЃКZ<W
D. XЕФзюИпМлбѕЛЏЮяЕФЫЎЛЏЮяЪЧЧПМю
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПГЃЮТЯТЃЌЯђБЅКЭТШЫЎжаж№ЕЮЕЮШы![]() ЕФЧтбѕЛЏФЦШмвКЃЌpHБфЛЏШчЭМЫљЪОЃЌЯТСагаЙиа№Ъіе§ШЗЕФЪЧ
ЕФЧтбѕЛЏФЦШмвКЃЌpHБфЛЏШчЭМЫљЪОЃЌЯТСагаЙиа№Ъіе§ШЗЕФЪЧ![]()

A.ЂйЕуЫљЪОШмвКжажЛДцдкHClOЕФЕчРыЦНКт
B.ЂкЕНЂлЕФЙ§ГЬжаЫЎЕФЕчРыГЬЖШвЛЖЈМѕЩй
C.ЂкЕуДІБэЪОТШЦјгыЧтбѕЛЏФЦШмвКЧЁКУЗДгІЭъШЋ
D.ЂкЕуЫљЪОШмвКжаЃК![]()
![]()
![]()
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊЃК2COЃЈgЃЉ+O2ЃЈgЃЉЃН2CO2ЃЈgЃЉЃЛЁїHЃНЉ566kJ/molЃЛNa2O2ЃЈsЃЉ+CO2ЃЈgЃЉЃНNa2CO3ЃЈsЃЉ+![]() O2(g)ЃЛЁїHЃНЉ226kJ/molЃЛИљОнвдЩЯШШЛЏбЇЗНГЬЪНХаЖЯЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
O2(g)ЃЛЁїHЃНЉ226kJ/molЃЛИљОнвдЩЯШШЛЏбЇЗНГЬЪНХаЖЯЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
A.COЕФШМЩеШШЮЊ283kJ
B.ШчЭМПЩБэЪОгЩCOЩњГЩCO2ЕФЗДгІЙ§ГЬКЭФмСПЙиЯЕ
C.2Na2O2ЃЈsЃЉ+2CO2ЃЈsЃЉЃН2Na2CO3ЃЈsЃЉ+O2ЃЈgЃЉЁїHЃМЉ452kJ/mol
D.COЃЈgЃЉгыNa2O2ЃЈsЃЉЗДгІЗХГі509kJШШСПЪБЃЌЕчзгзЊвЦЪ§ЮЊ1.204ЁС1024
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЗАЕчГиЪЧвЛжжаТаЭЫсадСђЫсбЮЖўДЮЕчГиЃЌЗАЕчГиЪЇаЇКѓЃЌЗЯЕчНтвКЛиЪеРћгУЕФвЛжжЙЄвеШчЯТ:

вбжЊ:a.+5МлЗАдкШмвКжаДцдкШчЯТЦНКт: ![]() ЁЃ
ЁЃ
b.ВПЗжКЌЗАЮяжЪдкЫЎжаЕФШмНтадМћЯТБэ:

(1)бѕЛЏЙЄађжаЃЌЦфЫћМлЬЌЕФЗАШЋВПбѕЛЏГЩ![]() ЃЌЭъГЩ
ЃЌЭъГЩ![]() бѕЛЏЕФРызгЗНГЬЪН:
бѕЛЏЕФРызгЗНГЬЪН:
_________V2++_________ClO3-+ _________=_________VO2+__________C1-+ __________NaClOКЭNaClO3ОљПЩзїбѕЛЏМСЃЌИУЙЄађжаВЛбЁдёNaClOзїбѕЛЏМСЕФРэгЩЪЧ_________ЁЃ
(2)ХЈЫѕЙЄађжаЃЌМгШыNaOHЕФзїгУЪЧ_________ЁЃ
(3)ГСЗАЙЄађЕФЛЏбЇЗНГЬЪНЮЊ_________ЁЃ
(4)ьбЩеЦЋЗАЫсяЇЪБЃЌЙЬЬх(ШЁ234g NH4VO3)жЪСПЕФМѕЩйСПЫцЮТЖШБфЛЏЕФЧњЯпШчЭМЫљЪОЃЌ100~200ЁцЪБВњЩњЕФвЛжжЦјЬхЕФЕчзгЪНЮЊ________ЃЌ300~350ЁцЪБЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЮЊ__________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТБэЪЧдЊЫижмЦкБэЕФвЛВПЗжЁЃБэжаЫљСаЕФзжФИЗжБ№ДњБэвЛжжЛЏбЇдЊЫиЃК

ЪдЛиД№ЯТСаЮЪЬтЃК(Д№АИжаЩцМАзжФИОљгУОпЬхдЊЫиЗћКХзїД№)
(1)IЕФдЊЫиЗћКХЮЊ___ЃЌ дкжмЦкБэжаЮЛгк______ЧјЁЃ
(2)аДГіAдзгЕФКЫЭтЕчзгХХВМЕФЕчзгХХВМЭМ _____________________ ЃЌаДГіЛљЬЌЪБJдЊЫиЛљЬЌдзгдзгЕФМлЕчзгХХВМЪН_______________ЃЌJдкжмЦкБэжаЕФЮЛжУЪЧ__________ЃЛ
(3)ABGHЕФдзгАыОЖДѓаЁЫГађЪЧ________________ЃЛABCDЕФЕквЛЕчРыФмДѓаЁЫГађЪЧ_______ЃЛABCDЕФЕчИКадДѓаЁЫГађЪЧ____________ЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com