
【题目】常温下,向饱和氯水中逐滴滴入![]() 的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是
的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是![]()

A.①点所示溶液中只存在HClO的电离平衡
B.②到③的过程中水的电离程度一定减少
C.②点处表示氯气与氢氧化钠溶液恰好反应完全
D.②点所示溶液中:![]()
![]()
![]()
【答案】D
【解析】
根据题意可知,本题综合考查氯气的性质、微粒浓度大小比较、弱电解质的电离等知识,运用氯气的性质、电荷守恒、物料守恒分析。
![]() 为饱和氯水,饱和氯水中存在次氯酸的电离平衡、水的电离平衡和氯气的溶解平衡,故A错误;
为饱和氯水,饱和氯水中存在次氯酸的电离平衡、水的电离平衡和氯气的溶解平衡,故A错误;
B.![]() 到
到![]() 的过程中,氯水中氢离子浓度逐渐减小,水的电离程度逐渐增大,当氯气和氢氧化钠溶液恰好完全反应时,水的电离程度达到最大,此时溶质为氯化钠和次氯酸钠,溶液呈碱性,而
的过程中,氯水中氢离子浓度逐渐减小,水的电离程度逐渐增大,当氯气和氢氧化钠溶液恰好完全反应时,水的电离程度达到最大,此时溶质为氯化钠和次氯酸钠,溶液呈碱性,而![]() 点为中性,说明
点为中性,说明![]() 到
到![]() 的过程中水的电离程度先增大,之后氢氧化钠过量后水的电离程度开始减小,故B错误;
的过程中水的电离程度先增大,之后氢氧化钠过量后水的电离程度开始减小,故B错误;
C.当氯气与氢氧化钠溶液恰好反应时生成氯化钠、次氯酸钠和水,次氯酸根离子部分水解,溶液呈碱性,而![]() 的
的![]() ,为中性溶液,说明氯水稍过量,二者没有恰好反应,故C错误;
,为中性溶液,说明氯水稍过量,二者没有恰好反应,故C错误;
D.![]() 点溶液中溶质为NaCl、NaClO、HClO,溶液呈中性,则
点溶液中溶质为NaCl、NaClO、HClO,溶液呈中性,则![]() ,根据电荷守恒得:
,根据电荷守恒得:![]() ,所以
,所以![]() ,由电子守恒可得:
,由电子守恒可得:![]() ,所以
,所以![]() ,故D正确;
,故D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】相同温度下,关于盐酸和醋酸两种溶液的比较,下列说法正确的是
A.pH相等的两溶液:c(CH3COO-)=c(Cl-)
B.等浓度的盐酸和醋酸中和相同物质的量的NaOH时,盐酸的体积小
C.同pH值时,稀释相同倍数后,醋酸溶液的pH值大
D.等pH值的盐酸和醋酸与铁粉反应,产生气体的速率盐酸快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锶(Sr)元素广泛存在于矿泉水中,是一种人体必需的微量元素,在元素周期表中与钙和钡属于第ⅡA族元素。
(1)碱性:Sr(OH)2___Ba(OH)2(填“<”或“>”;锶的化学性质与钙和钡类似,用原子结构的观点解释其原因是___。
(2)碳酸锶是最重要的锶化合物。用含SrSO4和少量BaSO4、BaCO3、FeO、Fe2O3、Al2O3、SiO2的天青石制备SrCO3,工艺流程如下(部分操作和条件略):
Ⅰ.将天青石矿粉和碳酸钠溶液混合后充分反应,过滤;
Ⅱ.向滤渣中加入足量盐酸充分反应,过滤;
Ⅲ.向Ⅱ所得滤液中加入足量的稀硫酸,过滤;
Ⅳ.向Ⅲ所得滤液中先加入氯水,充分反应后再用氨水调pH约为7,过滤;
Ⅴ.向Ⅳ所得滤液中加入稍过量的碳酸氢铵溶液,充分反应后过滤,将沉淀洗净,烘干,得SrSO3。
已知:ⅰ.相同温度时溶解度:BaSO4<SrCO3<SrSO4<CaSO4
ⅱ.生成氢氧化物沉淀的pH如下表所示:
物质 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀的pH | 1.9 | 7.0 | 3.4 |
完全沉淀的pH | 3.2 | 9.0 | 4.7 |
①步骤Ⅰ中,反应的化学方程式是______。为提高此步骤中锶的转化效果可以采取的措施有(任答两点即可):______。
②步骤Ⅱ中,能与盐酸反应而溶解的物质有______。
③步骤Ⅳ的目的是_______。
④下列关于该工艺流程的说法正确的是________(填字母代号)。
a.该工艺产生的废液含较多的NH4+、Na+、SO42-、Cl-
b.SiO2在步骤Ⅰ操作时被过滤除去
c.步骤Ⅴ中反应时,加入NaOH溶液可以提高NH4HCO3的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
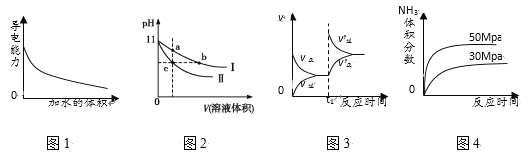
A. 图1表示一定量冰醋酸晶体加水过程中溶液导电性的变化
B. 图2表示某温度下,相同pH的氨水和氢氧化钠溶液分别加水稀释,a、b、c三点溶液的KW:c=b<a
C. 图3表示t1时刻改变的条件为升高温度,平衡向逆反应方向移动
D. 图4表示一定条件下,合成氨反应中压强对氨气体积分数的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,几种常见弱酸的Ka如下表所示[已知草酸(H2C2O4)是一种二元弱酸]:
弱酸 | H2C2O4 | CH3COOH | HCN | H2CO3 |
Ka | K1=5.6×10-2 K2=5.4×10-5 | 1.8×10-5 | 6.2×10-10 | K1=4.2×10-7 K2=5.6×10-11 |
(1)25 ℃时,0.1 mol·L-1的Na2C2O4、CH3COONa、NaCN、Na2CO3溶液的pH由大到小的顺序是________________________,中和等体积等pH的CH3COOH和HCN溶液消耗NaOH的物质的量________(填“前者大”或“后者大”)。
(2)KHC2O4溶液呈酸性。向10 mL 0.01 mol·L-1的H2C2O4溶液滴加0.01 mol·L-1KOH溶液V(mL),回答下列问题:
①当V<10 mL时,反应的离子方程式为________________________________。
②当V=10 mL时,溶液中HC2O![]() 、C2O
、C2O![]() 、H2C2O4、H+的浓度从大到小的顺序为_____________________。
、H2C2O4、H+的浓度从大到小的顺序为_____________________。
③当V=amL时,溶液中离子浓度有如下关系:c(K+)=2c(C2O![]() )+c(HC2O
)+c(HC2O![]() );当V=bmL时,溶液中离子浓度有如下关系:c(K+)=c(C2O
);当V=bmL时,溶液中离子浓度有如下关系:c(K+)=c(C2O![]() )+c(HC2O
)+c(HC2O![]() )+c(H2C2O4);则a________(填“<”“=”或“>”)b。
)+c(H2C2O4);则a________(填“<”“=”或“>”)b。
④当V=20 mL时,再滴入NaOH溶液,则溶液中n(K+)/n(C2O![]() )的值将________(
)的值将________(
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(原创)如图表示不同温度下水溶液中c(H+)与c(OH-)的关系,下列判断正确的是( )
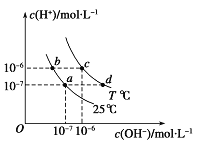
A.两条曲线上任意点均有c (H+) ×c (OH-)=Kw
B.T<25℃
C.b点和c点pH均为6,溶液呈酸性
D.只采用升温的方式,可由a点变成d点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)Z元素在周期表中的位置为_______________。
(2)下列事实能说明Y元素的非金属性比硫元素的非金属性强的是___________。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1mol硫得电子多
c.Y和硫两元素的简单氢化物受热分解,前者的分解温度高
(3)X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ。已知该化合物的熔、沸点分别为-69℃和58℃。写出该反应的热化学方程式:_____________。
(4)1mol碳与镁形成的化合物Q与4mo水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的电子式为____________。
(5)Q与水反应的化学方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将pH均为3,体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随lg![]() 的变化如图所示,下列叙述正确的是
的变化如图所示,下列叙述正确的是

A. 水的电离程度:b>c>a
B. 若分别用等浓度的NaOH溶液完全中和,消耗NaOH的体积:b>a>c
C. 若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:a>b>c
D. 溶液中离子总浓度: a>b>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用煤和水作原料经过多步反应制得氢气,其中一步反应的原理为CO(g)+H2O(g)![]() CO2(g)+H2(g),下列选项的条件中可判断该反应达到平衡状态的是( )
CO2(g)+H2(g),下列选项的条件中可判断该反应达到平衡状态的是( )
A. 单位时间内消耗2 mol的CO同时生成2 mol的CO2
B. 两个H—O键断裂的同时有一个H—H键断裂
C. 反应容器内的压强不再发生变化
D. 混合气体的相对分子质量不发生变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com