
【题目】一种碳纳米管能够吸附氢气,用这种材料制备的电池其原理如图所示,该电池的电解质为6mol·L-1KOH溶液。下列说法中不正确的是( )

A.放电时镍电极作负极
B.放电时K+移向正极
C.放电时碳电极的电极反应为H2-2e-+2OH-=2H2O
D.该反应过程中KOH溶液的浓度基本保持不变
【答案】A
【解析】
根据图示,NiO(OH)转化为Ni(OH)2中Ni元素的化合价降低,发生还原反应,因此镍电极是正极,反应式为NiO(OH)+H2O+e-═Ni(OH)2+OH-,碳电极是负极,电极反应式为H2+2OH--2e-=2H2O,据此分析解答。
A.根据上述分析,放电时,镍电极是正极,故A错误;
B.放电时,该电池为原电池,正极上NiO(OH)得电子发生还原反应,电解质溶液中阳离子向正极移动,所以钾离子向Ni电极移动,故B正确;
C.放电时,负极上氢气失电子发生氧化反应,电极反应式为H2+2OH--2e-═2H2O,故C正确;
D.总反应式为2NiO(OH)+H2=2Ni(OH)2,可知该反应过程中KOH溶液的浓度基本保持不变,故D正确;
故选A。


科目:高中化学 来源: 题型:
【题目】乙醇(C2H5OH)燃料电池(DEFC)具有很多优点,引起了人们的研究兴趣。现有以下三种乙醇燃料电池。

(1)三种乙醇燃料电池中正极反应物均为_________________。(填化学式)
(2)熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电池工作时,CO32-向电极___(填“a”或“b”)移动。
(3)酸性乙醇燃料电池中,若电池消耗标准状况下2.24L O2,则电路中通过了的电子数目为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含苯酚的工业废水的处理流程如图所示。

(1)①流程图设备Ⅰ中进行的是操作________(填写操作名称)。实验室里这一步操作可以用_______(填仪器名称)进行。
②由设备Ⅱ进入设备Ⅲ的物质A是______________(填化学式,下同)。由设备Ⅲ进入设备Ⅳ的物质B是___________。
③在设备Ⅲ中发生反应的化学方程式为_____________________。
④在设备Ⅳ中,物质B的水溶液和CaO反应后,产物是NaOH、H2O和______。通过 _________________(填操作名称)操作,可以使产物相互分离。
⑤图中,能循环使用的物质是_______、_____________C6H6和CaO。
(2)为了防止水源污染,用简单而又现象明显的方法检验某工厂排放的污水中有无苯酚,此方法是____________。
从废水中回收苯酚的方法是①用有机溶剂萃取废液中的苯酚;②加入某种药品的水溶液使苯酚与有机溶剂脱离;③加入某物质又析出苯酚。试写出②、③两步的反应方程式:_________________________。
(3)为测定废水中苯酚的含量,取此废水100 mL,向其中加入浓溴水至不再产生沉淀为止,得到沉淀0.331 g,求此废水中苯酚的含量____________(mg·L-1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示装置进行第二组实验。实验过程中,观察到与第一组实验不同的现象:两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。 查阅资料得知,高铁酸根离子(FeO42—)在溶液中呈紫红色。

(1)电解过程中,X 极区溶液的 pH__(填“增大”“减小”或“不变”)。
(2)电解过程中,Y 极发生的电极反应之一为 Fe﹣6e﹣+8OH﹣=FeO42—+4H2O 若在 X 极收集到672 mL 气体,在 Y 极收集到 168 mL 气体(均已折算为标准状况时气体体积),则 Y 电极(铁电极)质量减少__g。
(3)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为 2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的反应的电极反应式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组以CoCl36H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X。为确定其组成,进行如下实验。

①氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1 mLc1 molL-1的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2 molL-1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液。
②氯的测定:准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现淡红色沉淀不再消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
(1)装置中安全管的作用原理是___。
(2)用NaOH标准溶液滴定过剩的HCl时,应使用______式滴定管,可使用的指示剂为_______。
(3)样品中氨的质量分数表达式为_______。
(4)测定氨前应该对装置进行气密性检验,若气密性不好测定结果将_____(填“偏高”或“偏低”)。
(5)测定氯的过程中,使用棕色滴定管的原因是_____;滴定终点时,若溶液中c(Ag+)=2.0×10-5 molL-1,c(CrO42-)为_____ molL-1。(已知:K sp(Ag2CrO4)=1.12×10-12)
(6)经测定,样品X中钴氨氯的物质的量之比为1:6:3,钴的化合价为_____,制备X的化学方程式为______;X的制备过程中温度不能过高的原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,相同体积、相同pH的氨水和氢氧化钠溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是
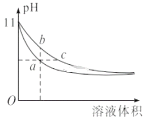
A. a点导电能力比b点强
B. a、c两点的c(H+)相等
C. 与盐酸完全反应时,消耗盐酸体积Va>Vc
D. b点的Kw值大于c点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是

A. 原子半径:W<X
B. 常温常压下,Y单质为固态
C. 气态氢化物热稳定性:Z<W
D. X的最高价氧化物的水化物是强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CO(g)+O2(g)=2CO2(g);△H=﹣566kJ/mol;Na2O2(s)+CO2(g)=Na2CO3(s)+![]() O2(g);△H=﹣226kJ/mol;根据以上热化学方程式判断,下列说法正确的是( )
O2(g);△H=﹣226kJ/mol;根据以上热化学方程式判断,下列说法正确的是( )
A.CO的燃烧热为283kJ
B.如图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H<﹣452kJ/mol
D.CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数为1.204×1024
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧化铈[Ce(OH)4]是一种重要的稀土氢氧化物。平板电视显示屏生产过程中会产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2),某课题组以此粉末为原料回收铈,设计实验流程如下:
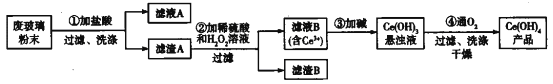
下列说法错误的是
A. 滤渣A中主要含有SiO2、CeO2
B. 过滤操作中用到的玻璃仪器有烧杯、漏斗、玻璃棒
C. 过程②中发生反应的离子方程式为CeO2+H2O2+3H+=Ce3++2H2O+O2↑
D. 过程④中消耗 11.2L O2(已折合成标准状况),转移电子数为2×6.02×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com