
【题目】铜的化合物如Cu2O、CuO、CuCl、CuSO4·5H2O、Cu(IO3)2、[Cu(H2NCH2CH2NH2)2]Cl2等均有着广泛的应用.回答下列问题:
(1)基态Cu2+的核外电子排布式为____________
(2)IO3-的空间构型为_____________________________(用文字描述),与SO42-互为等电子体的分子为____________
(3)配离子[Cu(H2NCH2CH2NH2)2]2+中,Cu2+的配位数是____________.
①乙二胺分子中N 原子轨道的杂化类型为____________.
② 1mol [Cu(H2NCH2CH2NH2)2]2+ 中含有的σ键的数目为____________.
(4)CuO的熔点比CuCl的熔点高,其原因是____________.
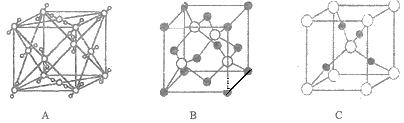
(5)Cu2O晶体结构可能是____________ (填字母).
【答案】1s22s22p6 3s23p63d9或[Ar]3d9 三角锥形 SiF4、CCl4等 4 sp3杂化 26 NA CuO的阴阳离子半径小于CuCl的阴阳离子半径,CuO阴阳离子所带电荷大于CuCl,由此可得CuO的晶格能更大 C
【解析】
(1)基态Cu2+的核外电子排布式为1s22s22p6 3s23p63d9或[Ar]3d9。
(2)IO3-中I与3个O原子形成共价键后,I的最外层还有一对孤对电子,对形成的三个共价键有排斥作用,从而使结构不对称;寻找与SO42-互为等电子体的分子时,可将O换成F或Cl,然后再通过价电子数相等,将S替换为C或Si。
(3) 配离子[Cu(H2NCH2CH2NH2)2]2+中,1个H2NCH2CH2NH2与Cu2+形成2个配位键,从而得出配位键的数目。
①乙二胺分子中N 原子,除去含有一对孤对电子外,还形成了3个共价键。
② 1mol [Cu(H2NCH2CH2NH2)2]2+ 中,1个H2NCH2CH2NH2含有11个共价单键,2个H2NCH2CH2NH2含有22个共价单键,另外,Cu2+与N还形成了4个配位键,从而得出含有的σ键的数目。
(4)CuO的熔点比CuCl的熔点高的原因,从离子所带电荷、离子半径寻找答案。
(5)从离子个数比为2:1,分析三个晶体结构,从而确定Cu2O晶体结构。
A中,顶点含8个分子,面心含6个分子,晶体共含4个分子;B中,顶点含8个黑球,面心含6个黑球,晶体内含有4个白球,该晶体中共含4个黑球,4个白球;C中,顶点含8个白球,体心含1个白球,晶体内含4个黑球,该晶体中共含有2个白球,4个黑球。
(1)基态Cu2+的核外电子排布式为1s22s22p6 3s23p63d9或[Ar]3d9。答案为:1s22s22p6 3s23p63d9或[Ar]3d9;
(2)IO3-中I与3个O原子形成共价键后,I的最外层还有一对孤对电子,对形成的三个共价键有排斥作用,从而使结构不对称,所以结构为三角锥形;寻找与SO42-互为等电子体的分子时,可将O换成F或Cl,然后再通过价电子数相等,将S替换为C或Si,从而得出分子为SiF4、CCl4等。答案为:三角锥形;SiF4、CCl4等;
(3) 配离子[Cu(H2NCH2CH2NH2)2]2+中,1个H2NCH2CH2NH2与Cu2+形成2个配位键,从而得出配位键的数目为4。答案为:4;
①乙二胺分子中N 原子,除去含有一对孤对电子外,还形成了3个共价键,从而得出N原子轨道的杂化类型为sp3杂化。答案为:sp3杂化;
② 1mol [Cu(H2NCH2CH2NH2)2]2+ 中,1个H2NCH2CH2NH2含有11个共价单键,2个H2NCH2CH2NH2含有22个共价单键,另外,Cu2+与N还形成了4个配位键,由此得出1个[Cu(H2NCH2CH2NH2)2]2+含有的σ键的数目为26个,从而得出1mol [Cu(H2NCH2CH2NH2)2]2+中,含26 NA个σ键。答案为:26 NA;
(4)CuO的熔点比CuCl的熔点高,原因是CuO的阴阳离子半径小于CuCl的阴阳离子半径,CuO阴阳离子所带电荷大于CuCl,由此可得CuO的晶格能更大。答案为:CuO的阴阳离子半径小于CuCl的阴阳离子半径,CuO阴阳离子所带电荷大于CuCl,由此可得CuO的晶格能更大;
(5)从离子个数比为2:1,分析三个晶体结构,从而确定Cu2O晶体结构为C(黑球与白球的个数比为2:1)。答案为:C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.有机物的表示方法多种多样,下面是常用的有机物的表示方法:
①![]() ②CH3CH2CH(CH3)CH3③CH4 ④
②CH3CH2CH(CH3)CH3③CH4 ④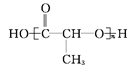 ⑤
⑤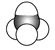
⑥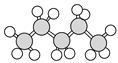 ⑦
⑦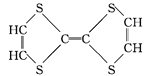 ⑧
⑧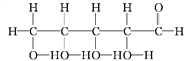
(1)上述表示方法中属于结构简式的是_______________(填序号,下同),属于比例模型的是_______。
(2)写出⑧中官能团的名称:____________、____________。
(3)____________和____________互为同分异构体。
Ⅱ.(1)写出下列有机物的结构简式:
①2,4二甲基3乙基己烷____________;
②2甲基2戊烯____________。
(2)对下列有机物进行命名:
①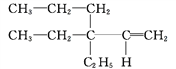 ____________。
____________。
②(CH3)3CCH(CH3)CH2CH3____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程中,最终的白色沉淀物不一定是BaSO4的是( )
A.Fe(NO3)2溶液![]() 白色沉淀
白色沉淀
B.Ba(NO3)2溶液![]() 白色沉淀
白色沉淀
C.无色溶液![]() 白色沉淀
白色沉淀
D.无色溶液![]() 无色溶液
无色溶液![]() 白色沉淀
白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下实验设计能达到实验目的的是( )
选项 | 实验目的 | 实验设计 |
A | 证明非金属性强弱:Cl>C>Si |
|
B | 鉴别NaBr和KI溶液 | 分别加新制氯水后,用CCl4萃取 |
C | 除去NaHCO3固体中的Na2CO3 | 将固体加热至恒重 |
D | 证明相同温度下: Ksp(Ag2S)<Ksp(AgCl) | 向2 mL 0.1 mol·L-1硝酸银溶液中加入1 mL 0.1 mol·L-1 NaCl溶液,出现白色沉淀,再加入 几滴0.1 mol·L-1 Na2S溶液,有黑色沉淀生成 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向10 mL 0.1 mol/L CuCl2溶液中滴加0.1mol/L的Na2S溶液,滴加过程中-lg c(Cu2+)与Na2S溶液体积的关系如图所示.下列有关说法正确的是( )

A.0.1mol/LNa2S溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S)
B.a、b、c三点对应的溶液中,水的电离程度最大的为b点
C.该温度下,Ksp(CuS)的数量级为10-36
D.向10 mL Ag+、Cu2+物质的量浓度均为0.1mol/L的混合溶液中逐滴加入0.01mol/L的Na2S溶液,Cu2+先沉淀[已知:Ksp(Ag2S)=6.4×10-50]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根皮素J(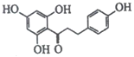 )是国外新近研究开发出来的一种新型天然美白剂,主要分布于苹果、梨等多汁水果的果皮及根皮.其中一种合成J的路线如下:
)是国外新近研究开发出来的一种新型天然美白剂,主要分布于苹果、梨等多汁水果的果皮及根皮.其中一种合成J的路线如下:
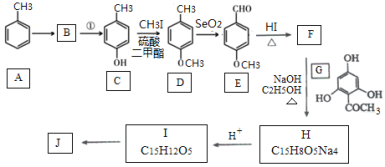
已知:
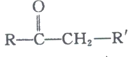 +R’’CHO
+R’’CHO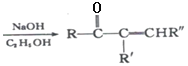 +H2O
+H2O
回答下列问题:
(1)C的化学名称是___________.E中的官能团的名称为_______________.
(2)B为溴代烃,请写出A→B的反应条件___________.
(3)写出由C生成D和由D生成E的反应类型___________、___________.
(4)F→H的化学方程式为______________________.
(5)M是E的同分异构体,同时符合下列条件的M的结构有___________种(不考虑立体异构)
①能与FeCl3溶液发生显色反应 ②能发生银镜反应
(6)设计以丙烯和1,3-丙二醛为起始原料制备![]() 的合成路线_______(无机试剂任选).
的合成路线_______(无机试剂任选).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,向Al2O3和过量C粉的混合物中通入氯气,可制得易水解的AlCl3,实验装置如图所示。下列说法不正确的是
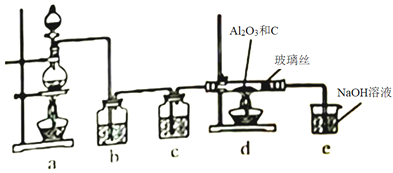
A. c中盛装的是浓硫酸
B. 实验时应先点燃d处酒精灯,再点燃a处酒精灯
C. 此反应中的尾气,除氯气外都可直接排放到大气中
D. 该装置不完善,其中应改进的一项是在d、e之间添加一个干燥装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】治理汽车尾气和燃煤尾气是环境保护的重要课题.请回答下列问题:
(1)在汽车排气系统中安装三元催化转化器,可发生反应:2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g).在恒容密闭容器中通入等量的CO和NO,发生上述反应时,c(CO)随温度(T)和时间(t)的变化曲线如图所示.
2CO2(g)+N2(g).在恒容密闭容器中通入等量的CO和NO,发生上述反应时,c(CO)随温度(T)和时间(t)的变化曲线如图所示.
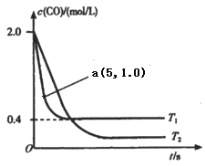
①据此判断该反应的正反应为____(填“放热”或“吸热”)反应.
②温度T1时,该反应的平衡常数K=_____;反应速率v=v(正)-v(逆)=k正c2(NO)c2(CO)- k逆c2(CO2)c(N2),k正、k逆分别为正、逆反应速率常数,计算a处v(正):v(逆)=________.
(2)下图流程是一种新型的除去尾气中氮氧化物的技术,一般采用氨气或尿素作还原剂
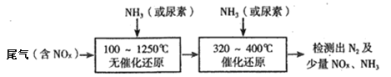
该技术中用尿素[CO(NH2)2]作还原剂还原NO2的主要反应为:4CO(NH2)2+6NO2![]() 4CO2+7N2+8H2O ,则用NH3作还原剂还原尾气中NO(NH3、NO的物质的量之比为1:1)的化学方程式为:______.
4CO2+7N2+8H2O ,则用NH3作还原剂还原尾气中NO(NH3、NO的物质的量之比为1:1)的化学方程式为:______.
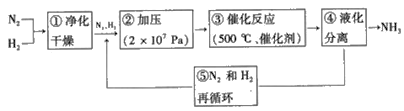
(3)哈伯法合成氨的流程图如图,下列五个流程中为提高原料利用率而采取的措施________(填序号)
(4)一种电化学制备NH3的装置如图所示,图中陶瓷在高温时可以传输H+.下列叙述正确的是______________(填选项)
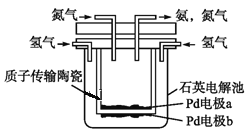
A.Pd电极b为阴极 B.阴极的反应式为N2+6H++6e-=2NH3
C.H+由阳极向阴极迁移 D.陶瓷可以隔离N2和H2
(5)也可用CH4催化还原NOx法消除烟气中氮氧化物的污染.已知:
①CH4(g)+ 2NO2(g)= N2(g)+CO2(g)+2H2O(g) △H=-867.0kJ/mol;
②N2(g)+2O2(g)= 2NO2(g) △H=+67.0 kJ/mol;
③N2(g)+O2(g)=2NO(g) △H=+89.0 kJ/mol
则CH4催化还原NO的热化学方程式为__________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,在氨
时,在氨![]() 水体系中不断通入
水体系中不断通入![]() ,各种离子变化趋势如图所示。下列说法不正确的是
,各种离子变化趋势如图所示。下列说法不正确的是

A.当![]() 时,会有中间产物
时,会有中间产物![]() 生成
生成
B.在![]() 时,溶液中存在关系:
时,溶液中存在关系:![]()
C.在![]() 时,溶液中存在关系:
时,溶液中存在关系:![]()
D.随着![]() 的通入,
的通入,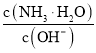 不断减小
不断减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com