
【题目】三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料。回答下列问题:
对于反应2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。
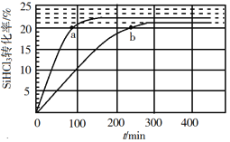
在343K下:要提高SiHCl3转化率,可采取的措施是___;要缩短反应达到平衡的时间,可采取的措施有___、___。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某实验探究小组进行如下实验,探究化学反应中的能量变化。
实验① | 实验② |
|
|
温度计读数升高 | 温度计读数降低 |
下列判断一定正确的是( )
A.实验①的反应中化学键断裂吸收的能量大于实验②
B.实验①的反应中化学键断裂吸收的能量小于实验②的反应中化学键形成放出的能量
C.实验①说明中和反应放出热量
D.实验②说明所有有氨气生成的反应均吸收热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种天然气臭味添加剂的绿色合成方法为:CH3CH2CH=CH2+H2S ![]() CH3CH2CH2CH2SH。下列反应的原子利用率与上述反应相近的是
CH3CH2CH2CH2SH。下列反应的原子利用率与上述反应相近的是
A. 乙烯与水反应制备乙醇
B. 苯和硝酸反应制备硝基苯
C. 乙酸与乙醇反应制备乙酸乙酯
D. 甲烷与Cl2反应制备一氯甲烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)下列几组物质中,互为同系物的有______________,互为同分异构体的有______________。
①O2和O3
②35Cl和37Cl
③CH3CH3和CH3CH2CH3
④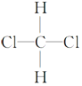 和
和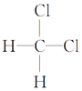
⑤CH3(CH2)2CH3和(CH3)2CHCH3
(2)烷烃A在同温同压下蒸气的密度是H2的43倍,该烃的分子式为______________。分子式为C8Hn的烯烃B中n为______________。
(3)相对分子质量为58的烷烃C的结构有______________种;试分别写出它们的结构简式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,电离常数:
化学式 | CH3COOH | H2CO3 | HCN |
电离常数 | 1.8×10-5 | K1:4.3×10-7 K2:5.6×10-11 | 4.9×10-10 |
请回答下列问题:
(1)物质的量浓度为0.1mol·L-1的下列四种物质:
a.Na2CO3 b.NaCN c.CH3COONa d.NaHCO3
pH由大到小的顺序是____(填标号)。
(2)25℃时,在0.5mol·L-1的醋酸溶液中由醋酸电离出的c(H+)约是由水电离出的c(H+)的__倍。
(3)写出向氰化钠溶液中通入少量二氧化碳的离子方程式:______。
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=___(填准确数值)。c(CH3COO-)/c(CH3COOH)=____。
(5)25℃时,将amol·L-1的醋酸与bmol·L-1氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离常数为____。
(6)某温度时,纯水的pH=6。该温度下0.01mol/LNaOH溶液的pH=___,向该温度下的纯水中加入少量的碳酸钠固体,使溶液pH为9,则水电离出的c(OH-)=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
教材插图具有简洁而又内涵丰富的特点。请回答以下问题:
(1)第三周期的某主族元素,其第一至第五电离能数据如图1所示,则该元素对应的原子有_____种不同运动状态的电子。
(2)如图2所示,每条折线表示周期表ⅣA ~ⅦA 中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是___________。判断依据是____________。
(3)CO2在高温高压下所形成的晶体其晶胞如图3所示。则该晶体的类型属于_____________晶体。
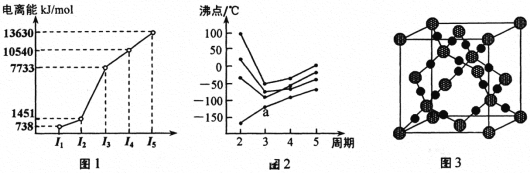
(4)第一电离能介于Al、P之间的第三周期元素有____种。 GaCl3中中心原子的杂化方式为_________,写出与GaCl3结构相同的一种等电子体(写离子)______________。
(5)冰、干冰、碘都是分子晶体,冰的结构具有特殊性,而干冰、碘的晶体具有相似的结构特征,干冰分子中一个分子周围有__________个紧邻分子。 D的醋酸盐晶体局部结构如图,该晶体中含有的化学键是_____________(填字母标号)。
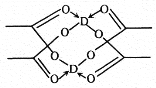
a.极性键 b.非极性键 c.配位键 d.金属键
(6)Fe的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的A~D图中正确的是_____(填字母标号)。

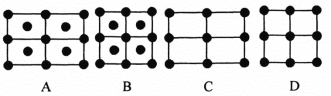
铁原子的配位数是____________,假设铁原子的半径是r cm,该晶体的密度是ρg/cm3 ,则铁的相对原子质量为________________(设阿伏加德罗常数的值为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
回答下列问题:
(1)反应①的化学平衡常数K的表达式为___;图1中能正确反映平衡常数K随温度变化关系的曲线为___(填曲线标记字母),其判断理由是___。
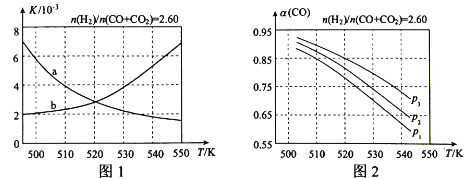
(2)合成气的组成![]() =2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。α(CO)值随温度升高而___(填“增大”或“减小”),其原因是___。图2中的压强由大到小为___,其判断理由是___。
=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。α(CO)值随温度升高而___(填“增大”或“减小”),其原因是___。图2中的压强由大到小为___,其判断理由是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3经一系列反应可以得到HNO3,如图所示。
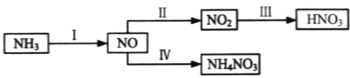
II中,2NO(g)+O2![]() 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如图)。
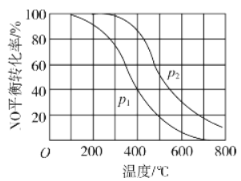
①比较P1、P2的大小关系:___。
②随温度升高,该反应平衡常数变化的趋势是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)是一种应用前景广阔的清洁燃科,以CO和氢气为原料生产二甲醚主要发生以下三个反应:
编号 | 热化学方程式 | 化学平衡常数 |
① | CO(g)+2H2(g) | K1 |
② | 2CH3OH(g) | K2 |
③ | CO(g)+H2O(g) | K3 |
回答下列问题:
工艺中反应①和反应②分别在不同的反应器中进行,无反应③发生。该工艺中反应③的发生提高了CH3OCH3的产率,原因是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com