
【题目】甲烷、乙烯是两种重要的有机化合物,回答下列问题:
(1)工业上以乙烷(C2H6)为原料,用传统的热裂解法或现在的氧化裂解法制取乙烯:
①C2H6(g)=C2H4(g) +H2(g) ΔH1=+136kJ/mol;
②2C2H6(g)+O2(g)=2C2H4(g)+2H2O(g) ΔH2=-220kJ/mol
已知上述反应中部分化学键键能数据如下表:
化学能 | H-H(g) | H-O(g) | O=O(g) |
键能( kJ/mol) | 436 | a | 496 |
由此计算a=_________。
(2)甲烷可用于消除氮氧化物NO2:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g),在温度为T1和T2时,分别降0.5molCH4和1.2molNO2充入1L恒容密闭容器中发生反应,测得有关数据如下表:
N2(g)+CO2(g)+2H2O(g),在温度为T1和T2时,分别降0.5molCH4和1.2molNO2充入1L恒容密闭容器中发生反应,测得有关数据如下表:
温度 | 物质的量 时间/min | 0 | 10 | 20 | 40 | 50 |
T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | x | 0.15 |
①温度为T1时,0—10min内NO2的平均反应速率v(NO2)=__________________。
②根据表中数据判断T1 _________T2(填“>”“<”或“=”),当温度为T2时反应进行到40min时,x_______0.15(填“>”“<”或“=”),该反应为_________(填“放热”或“吸热”)反应。
③单位时间内形成C—H键与形成C==O氧键的数目之比为_________时,说明反应达到平衡状态。
④温度为T2时,若相平衡后的容器中再充入0.5molCH4和1.2molNO2,重新达到平衡时,n(N2)的范围是__________________。
(3)甲烷、乙烯完全燃烧均生成CO2,常温下H2CO3![]() H++HCO3- Ka1=4.3×10-7;HCO3-
H++HCO3- Ka1=4.3×10-7;HCO3-![]() H++CO3-2- Ka2=5.6×10-11;NH3·H2O
H++CO3-2- Ka2=5.6×10-11;NH3·H2O![]() NH4++OH- Kb=1.8×10-5;用氨水吸收CO2生成NH4HCO3溶液,则NH4HCO3溶液显_________(填“酸性”“碱性”或“中性”),计算反应NH4++HCO3-+H2O
NH4++OH- Kb=1.8×10-5;用氨水吸收CO2生成NH4HCO3溶液,则NH4HCO3溶液显_________(填“酸性”“碱性”或“中性”),计算反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=_________(结果保留小数点后1位)
NH3·H2O+H2CO3的平衡常数K=_________(结果保留小数点后1位)
【答案】465 0.03mol·L-1·min-1 < = 放热 2:1 0.35mol<n(N2)<0.7mol 碱性 1.3×10-3
【解析】
(1)由②—①×2计算可得到:2H2(g)+O2(g)=2H2O(g ) △H=-492kJ/mol,带入键能计算(2×436+496)-4a=-492,a=465 kJ/mol;
故答案为:465;
(2)①v(NO2)=2×v(CH4)= ![]() =
=![]() =0.03mol·L-1·min-1;
=0.03mol·L-1·min-1;
故答案为:0.03mol·L-1·min-1;
②由表中数据可知,前20min内温度T2的平均反应速率大于温度T1的平均反应速率,则温度T2>T1,T2温度先达到平衡时间小于40min,50min处于平衡状态,此时甲烷的物质的量为0.15mol,大于T1温度平衡时的0.1mol,说明平衡逆向移动,则正反应为放热反应;
故答案为:< ,=,放热;
③相同时间内形成4molC—H键时形成2molC=O键,说明反应达到平衡状态;
故答案为:2:1;
④假如平衡不能发生移动,则重新达到平衡时,n(N2)=0.70mol。而实际上,反应物物质的浓度成比例增大,既增大了压强,平衡向气体体积减小的逆反应方向移动,根据勒夏特列原理n(N2)比原平恒大,所以0.35mol<n(N2)<0.70mol;
故答案为:0.35mol<n(N2)<0.7mol;
(3)由Ka1和Kb计算,Kh(HCO3- )>Kh(NH4+),即HCO3- 的水解程度大于NH4+的水解程度,所以NH4HCO3溶液显碱性,反应NH4++HCO3-+H2O═NH3H2O+H2CO3的平衡常数为:K=![]() ,分子、分母同时乘以c(H+)c(OH-)可得:K=
,分子、分母同时乘以c(H+)c(OH-)可得:K=![]() =
=![]() =1.3×10-3;
=1.3×10-3;
故答案为:碱性,1.3×10-3。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 某温度下纯水pH=6,则在该条件下pH=4的醋酸和pH=10的NaOH中水的电离程度相同
B. NH4Cl在D2O溶液中水解的离子方程式:NH4++D2O ![]() NH3·D2O+H+
NH3·D2O+H+
C. 已知S的燃烧热为Q kJ/mol,则S(s)+3/2O2(g)=SO3(g) ΔH=-Q kJ/mol
D. 水的自偶电离方程式:2H2O ![]() H3O++OH-,则液氨自偶电离方程式:2NH3
H3O++OH-,则液氨自偶电离方程式:2NH3 ![]() NH4++NH2-
NH4++NH2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置,在仪器①②③中分别依次加入下列各选项中所对应的试剂进行实验,能达到实验目的的是

A. 浓盐酸、浓硫酸、浓硫酸,制取干燥的氯化氢气体
B. 浓盐酸、二氧化锰、饱和食盐水,制取纯浄的氯气
C. 稀硫酸、溶液X、澄清石灰水,检验溶液X中是否含有CO32—
D. 浓盐酸、碳酸钙、水玻璃,验证盐酸、碳酸、硅酸的酸性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A是一种重要的化工原料,以A为主要起始原料,通过下列途径可以合成高分子材
料PA及PC。

试回答下列问题
(1)B的化学名称为________,B到C的反应条件是_____________。
(2)E到F的反应类型为__________,高分子材料PA的结构简式为________。
(3)由A生成H的化学方程式为______________________。
(4)实验室检验有机物A,可选择下列试剂中的_____________。
a.盐酸 b.FeCl3溶液 C. NaHCO3溶液 d.浓溴水
(5)E的同分异构中,既能与碳酸氢钠溶液反应、又能发生银镜反应的有机物共有_____种。其中核磁共振氢谐图有5组峰,且峰面积之比为6:1:1:1:1的物质的结构简式为____。
(6)由B通过三步反应制备1.3-环己二烯的合成路线为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在0.1mol/L的草酸(H2C2O4)溶液中加入等浓度的NaOH溶液,H2C2O4、HC2O4-、C2O42-三种微粒的物质的量分数(δ)与溶液pH的变化如图所示。下列说法不正确的是

A. 反应过程中c(H2C2O4)+c(HC2O4-)+c(C2O42-)<0.1mol/L
B. lg[K1(H2C2O4)]=-1.2
C. NaHC2O4溶液中c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-)
D. 当NaOH溶液与H2C2O4溶液体积之比为3:2时,2c(Na+)+c(OH-)=2c(H2C2O4)+c(HC2O4-)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以煤、石油综合利用的产品为原料合成最常用的增型剂(邻苯二甲酸二丁酯)的生产流程如图:
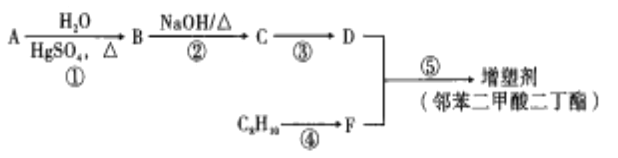
已知:
①烃A是在核磁共振氢谱中只有一组峰的直线型分子;
②R—CHO+CH3CHO![]() R—CHO+H2O;
R—CHO+H2O;
③烷基苯在高锰酸钾酸性溶液的作用下,侧链被氧化成羧基。
回答下列问题:
(1)下列说法正确的是__________(填序号)。
A.煤、石油均为常见的有机物
B.煤中含有苯和甲苯,可以用先干馏后分流的方法把它们分离出来
C.将煤在空气中加强热使之分解的过程,称为煤的干馏,也叫煤的焦化
D.石油催化裂化的过程是为了得到乙烯、丙烯、甲烷等重要化工原料
E.石油在加热和催化剂作用下,可通过结构重新调整,使链状烃转化为环状烃
(2)C8H10的名称为_______________。
(3)反应③和⑤和反应类型分别是__________、__________。
(4)写出反应⑤的化学方程式:______________________________。
(5)在F的同分异构体中,满足下列条件的共有__________种,所有的这些同分异构体中,不同化学环境氢原子的种数____________________(填“相同”和“不相同”)。
a.能与新制的Cu(OH)2悬浊液在加热的条件下反应生成砖红色沉淀
b.能与Na2CO3反应生成CO2
c.能使FeCl3溶液显色
(6)参照上述合成路线,设计一条以乙醇为原料制备1—丁醇的合成路线(无机试剂任用)。合成路线流程示例如下:CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH________________________________________________ 。
CH3CH2OH________________________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. NO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构
B. P4和CH4都是正四面体型分子且键角都为109.5°
C. NH4+的电子式为 ,离子呈平面正方形结构
,离子呈平面正方形结构
D. NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)25℃,有pH=12的氢氧化钠溶液100mL,要使它的pH降为11.应加蒸馏水的体积为________mL;若加pH=10的氢氧化钠溶液,应加________mL.
(2)某温度下,纯水的c(H+)=3×10﹣7mol/L,Na2S和NaOH两溶液的pH均为12,则两溶液中由水电离出的c(OH﹣)的比值为 ________.
(3)已知 Na2SO4(s)+4H2(g)Na2S(s)+4H2O(g)该温度下,在2L盛有2.84g Na2SO4的密闭容器中通入H2气体,10分钟后测得固体质量为2.264g.则10分钟内H2的平均反应速率为________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种电催化合成氨的装置如图所示。该装置工作时,下列说法正确的是

A. 图中涉及的能量转化方式共有3种
B. 两极产生的气体的物质的量之比是1:1
C. 电路中每通过1mol电子,有1mol H+迁移至a极
D. b极上发生的主要反应为N2+6H++6e-=2NH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com