
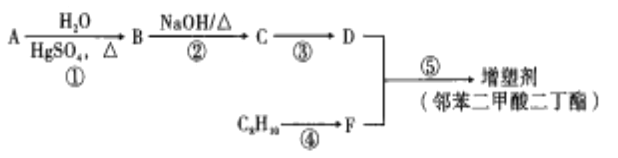
ЁОЬтФПЁПвдУКЁЂЪЏгЭзлКЯРћгУЕФВњЦЗЮЊдСЯКЯГЩзюГЃгУЕФдіаЭМС(СкБНЖўМзЫсЖўЖЁѕЅ)ЕФЩњВњСїГЬШчЭМЃК
вбжЊЃК
ЂйЬўAЪЧдкКЫДХЙВеёЧтЦзжажЛгавЛзщЗхЕФжБЯпаЭЗжзгЃЛ
ЂкRЁЊCHO+CH3CHO![]() RЁЊCHO+H2OЃЛ
RЁЊCHO+H2OЃЛ
ЂлЭщЛљБНдкИпУЬЫсМиЫсадШмвКЕФзїгУЯТЃЌВрСДБЛбѕЛЏГЩєШЛљЁЃ
ЛиД№ЯТСаЮЪЬтЃК
(1)ЯТСаЫЕЗЈе§ШЗЕФЪЧ__________(ЬюађКХ)ЁЃ
A.УКЁЂЪЏгЭОљЮЊГЃМћЕФгаЛњЮя
B.УКжаКЌгаБНКЭМзБНЃЌПЩвдгУЯШИЩСѓКѓЗжСїЕФЗНЗЈАбЫќУЧЗжРыГіРД
C.НЋУКдкПеЦјжаМгЧПШШЪЙжЎЗжНтЕФЙ§ГЬЃЌГЦЮЊУКЕФИЩСѓЃЌвВНаУКЕФНЙЛЏ
D.ЪЏгЭДпЛЏСбЛЏЕФЙ§ГЬЪЧЮЊСЫЕУЕНввЯЉЁЂБћЯЉЁЂМзЭщЕШживЊЛЏЙЄдСЯ
E.ЪЏгЭдкМгШШКЭДпЛЏМСзїгУЯТЃЌПЩЭЈЙ§НсЙЙжиаТЕїећЃЌЪЙСДзДЬўзЊЛЏЮЊЛЗзДЬў
(2)C8H10ЕФУћГЦЮЊ_______________ЁЃ
(3)ЗДгІЂлКЭЂнКЭЗДгІРраЭЗжБ№ЪЧ__________ЁЂ__________ЁЃ
(4)аДГіЗДгІЂнЕФЛЏбЇЗНГЬЪНЃК______________________________ЁЃ
(5)дкFЕФЭЌЗжвьЙЙЬхжаЃЌТњзуЯТСаЬѕМўЕФЙВга__________жжЃЌЫљгаЕФетаЉЭЌЗжвьЙЙЬхжаЃЌВЛЭЌЛЏбЇЛЗОГЧтдзгЕФжжЪ§____________________(ЬюЁАЯрЭЌЁБКЭЁАВЛЯрЭЌЁБ)ЁЃ
a.ФмгыаТжЦЕФCu(OH)2аќзЧвКдкМгШШЕФЬѕМўЯТЗДгІЩњГЩзЉКьЩЋГСЕэ
b.ФмгыNa2CO3ЗДгІЩњГЩCO2
c.ФмЪЙFeCl3ШмвКЯдЩЋ
(6)ВЮееЩЯЪіКЯГЩТЗЯпЃЌЩшМЦвЛЬѕвдввДМЮЊдСЯжЦБИ1ЁЊЖЁДМЕФКЯГЩТЗЯп(ЮоЛњЪдМСШЮгУ)ЁЃКЯГЩТЗЯпСїГЬЪОР§ШчЯТЃКCH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH________________________________________________ ЁЃ
CH3CH2OH________________________________________________ ЁЃ
ЁОД№АИЁПE СкЖўМзБН(1ЃЌ2ЁЊЖўМзБН) МгГЩЗДгІЛђЛЙдЗДгІ ШЁДњЗДгІЛђѕЅЛЏЗДгІ  10 ЯрЭЌ CH3CH2OH
10 ЯрЭЌ CH3CH2OH![]() CH3CHO
CH3CHO![]() CH3CH=CHCHO
CH3CH=CHCHO![]() CH3CH2CH2CH2OH
CH3CH2CH2CH2OH
ЁОНтЮіЁП
ИљОнаХЯЂЬсЪОЃЌРћгУВњЮяНсЙЙФцЯђЭЦРэЗДгІЮяНсЙЙЃЛИљОнгаЛњЛЏКЯЮяЕФНсЙЙКЭаджЪЗжЮіНтД№ЁЃ
ИљОнВњЮяФцЭЦDЁЂFЗжБ№ЮЊCH3CH2CH2CH2OHКЭ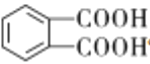 ЃЌдђC8H10ЮЊСкЖўМзБНЃЌБЛбѕЛЏЕУЕНСкБНЖўМзЫсЃЌгЩгкDЕФЖЁДМдђФцЯђЭЦЖЯГіCЪЧЖЁШЉЃЌгжИљОнаХЯЂЬсЪОЂкПЩжЊЃЌBЮЊввШЉЃЌМгЩЯЬўAЪЧдкКЫДХЙВеёЧтЦзжажЛгавЛзщЗхЕФжБЯпаЭЗжзгЃЌЫљвдAЮЊввШВЃЛ
ЃЌдђC8H10ЮЊСкЖўМзБНЃЌБЛбѕЛЏЕУЕНСкБНЖўМзЫсЃЌгЩгкDЕФЖЁДМдђФцЯђЭЦЖЯГіCЪЧЖЁШЉЃЌгжИљОнаХЯЂЬсЪОЂкПЩжЊЃЌBЮЊввШЉЃЌМгЩЯЬўAЪЧдкКЫДХЙВеёЧтЦзжажЛгавЛзщЗхЕФжБЯпаЭЗжзгЃЌЫљвдAЮЊввШВЃЛ
(1)УКЁЂЪЏгЭОљЮЊЛьКЯЮяЃЌЙЪAДэЮѓЃЛУКжаВЛКЌБНКЭМзБНЃЌЙЪBДэЮѓЃЛНЋУКИєОјПеЦјМгЧПШШЗжНтЕФЙ§ГЬГЦЮЊУКЕФИЩСѓЃЌЙЪCДэЮѓЃЛЪЏгЭЕФДпЛЏСбЛЏЪЧЪЙжижЪгЭЗЂЩњСбЛЏЗДгІЃЌзЊБфЮЊСбЛЏЦјЁЂЦћгЭКЭВёгЭЕШЕФЙ§ГЬЃЌДпЛЏСбНтЃЌЪЧдкДпЛЏМСДцдкЕФЬѕМўЯТЃЌЖдЪЏгЭЬўРрНјааСЫИпЮТСбНтРДЩњВњввЯЉЁЂБћЯЉЁЂЖЁЯЉЕШЕЭЬМЯЉЬўЕФЙ§ГЬЃЌЙЪDДэЮѓЃЛЪЏгЭдкМгШШКЭДпЛЏМСзїгУЯТЃЌПЩЭЈЙ§НсЙЙжиаТЕїећЃЌЪЙСДзДЬўзЊЛЏЮЊЛЗзДЬўЃЌЙЪEе§ШЗЃЌ
ЙЪД№АИЮЊEЃЛ
(2)гЩЩЯЪіЗжЮіПЩжЊC8H10ЮЊСкЖўМзБНЃЌ
ЙЪД№АИЮЊЃКСкЖўМзБНЃЛ
(3) ЗДгІЂлЪЧНЋЖЁШЉгыЧтЦјЗЂЩњМгГЩЗДгІзЊЛЏГЩЖЁДМЃЌЗДгІЂнЪЧСкБНЖўМзЫсгыЖЁДМЗЂЩњѕЅЛЏЗДгІЩњГЩСкБНЖўМзЫсЖўЖЁѕЅКЭЫЎЃЌ
ЙЪД№АИЮЊЃКМгГЩЗДгІЛђЛЙдЗДгІЃЌШЁДњЗДгІЛђѕЅЛЏЗДгІЃЛ
(4)ЗДгІЗДгІЂнЪЧСкБНЖўМзЫсгыЖЁДМЗЂЩњѕЅЛЏЗДгІЩњГЩСкБНЖўМзЫсЖўЖЁѕЅКЭЫЎЃЌЗНГЬЪНЮЊЃК![]() ЃЛ
ЃЛ
ЙЪД№АИЮЊЃК![]() ЃЛ
ЃЛ
(5)ТњзуЬѕМўЕФНсЙЙМАдкБНЛЗЩЯСЌ1ИіЁЊCOOHЁЂ1ИіЁЊOHЁЂ1ИіЁЊCHOЃЌЙВ10ИіЭЌЗжвьЙЙЬхЃЌОљЮЊ6жжЛЏбЇЛЗОГВЛЭЌЕФЧтдзгЃЛ
ЙЪД№АИЮЊЃК10ЃЌЯрЭЌЃЛ
(6) ЪзЯШввДМзЊЛЏГЩввШЉЃЌИљОнаХЯЂЬсЪОЂкЃЌввШЉзЊЛЏЮЊ2ЁЊЖЁЯЉШЉЃЌзюКѓгыЧтЦјЗЂЩњМгГЩЗДгІЕУЕНЖЁДМЃЌ![]() ЃЛ
ЃЛ
ЙЪД№АИЮЊЃК![]() ЁЃ
ЁЃ


 аЁбЇЩњ10ЗжжгПкЫуВтЪд100ЗжЯЕСаД№АИ
аЁбЇЩњ10ЗжжгПкЫуВтЪд100ЗжЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПШ§ИіУмБеШнЦїжаЗжБ№ГфШыN2ЁЂH2ЁЂO2Ш§жжЦјЬхЃЌвдЯТИїжжЧщПіЯТХХађе§ШЗЕФЪЧЃЈ ЃЉ
A. ЕБЫќУЧЕФЮТЖШКЭбЙЧПОљЯрЭЌЪБЃЌШ§жжЦјЬхЕФУмЖШЃКІбЃЈH2ЃЉЃОІбЃЈN2ЃЉЃОІбЃЈO2ЃЉ
B. ЕБЫќУЧЕФЮТЖШКЭУмЖШЖМЯрЭЌЪБЃЌШ§жжЦјЬхЕФбЙЧПЃКpЃЈH2ЃЉЃОpЃЈN2ЃЉЃОpЃЈO2ЃЉ
C. ЕБЫќУЧЕФжЪСПКЭЮТЖШЁЂбЙЧПОљЯрЭЌЪБЃЌШ§жжЦјЬхЕФЬхЛ§ЃКVЃЈO2ЃЉЃОVЃЈN2ЃЉЃОVЃЈH2ЃЉ
D. ЕБЫќУЧЕФбЙЧПКЭЬхЛ§ЁЂЮТЖШОљЯрЭЌЪБЃЌШ§жжЦјЬхЕФжЪСПЃКmЃЈH2ЃЉЃОmЃЈN2ЃЉЃОmЃЈO2ЃЉ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдкЯТСаЗДгІжаЃЌЕЅжЪжЛзїбѕЛЏМСЕФЪЧ
A.2F2+2H2OЈT4HF+O2Ёќ
B.Cl2+2NaOHЈTNaCl+NaClO+H2O
C.2Na+2H2OЈT2NaOH+H2Ёќ
D.H2+CuO![]() H2O+Cu
H2O+Cu
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвдLiPF6КЭSO(CH3)2ЮЊЕчНтжЪЕФИпФмяЎЕчГиЕФзмЗДгІЪНЮЊ2Li+FeS=Fe+LiSЃЌгУИУЕчГиЮЊЕчдДНјааШчЭМЕФЕчНтЪЕбщЃЌЕчНтвЛЖЮЪБМфВтЕУМзЕчГиВњЩњБъзМзДПіЯТH24.48LЁЃЯТСагаЙиа№Ъіе§ШЗЕФЪЧ

A. YЕчМЋЮЊИпФмяЎЕчГиЕФИКМЋДгИєФЄжаЭЈЙ§ЕФРызгЪ§ФПЮЊ0.4NA
B. ЕчНтГижаЛЛГЩвѕРызгНЛЛЛФЄЃЌзмЗДгІВЛЗЂЩњБфЛЏ
C. ШєЕчНтЙ§ГЬЬхЛ§БфЛЏКіТдВЛМЦЃЌдђЕчНтКѓМзГижаШмвКХЈЖШЮЊ4mol/L
D. ЕчдДе§МЋЗДгІЪНЮЊ:FeS+2Li++2e-=Fe+Li2S
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПМзЭщЁЂввЯЉЪЧСНжжживЊЕФгаЛњЛЏКЯЮяЃЌЛиД№ЯТСаЮЪЬтЃК
(1)ЙЄвЕЩЯвдввЭщ(C2H6)ЮЊдСЯЃЌгУДЋЭГЕФШШСбНтЗЈЛђЯждкЕФбѕЛЏСбНтЗЈжЦШЁввЯЉЃК
ЂйC2H6(g)=C2H4(g) +H2(g) ІЄH1=+136kJ/molЃЛ
Ђк2C2H6(g)+O2(g)=2C2H4(g)+2H2O(g) ІЄH2=-220kJ/mol
вбжЊЩЯЪіЗДгІжаВПЗжЛЏбЇМќМќФмЪ§ОнШчЯТБэЃК
ЛЏбЇФм | H-H(g) | H-O(g) | O=O(g) |
МќФм( kJ/mol) | 436 | a | 496 |
гЩДЫМЦЫуa=_________ЁЃ
(2)МзЭщПЩгУгкЯћГ§ЕЊбѕЛЏЮяNO2ЃКCH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g)ЃЌдкЮТЖШЮЊT1КЭT2ЪБЃЌЗжБ№НЕ0.5molCH4КЭ1.2molNO2ГфШы1LКуШнУмБеШнЦїжаЗЂЩњЗДгІЃЌВтЕУгаЙиЪ§ОнШчЯТБэЃК
N2(g)+CO2(g)+2H2O(g)ЃЌдкЮТЖШЮЊT1КЭT2ЪБЃЌЗжБ№НЕ0.5molCH4КЭ1.2molNO2ГфШы1LКуШнУмБеШнЦїжаЗЂЩњЗДгІЃЌВтЕУгаЙиЪ§ОнШчЯТБэЃК
ЮТЖШ | ЮяжЪЕФСП ЪБМф/min | 0 | 10 | 20 | 40 | 50 |
T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | x | 0.15 |
ЂйЮТЖШЮЊT1ЪБЃЌ0ЁЊ10minФкNO2ЕФЦНОљЗДгІЫйТЪv(NO2)=__________________ЁЃ
ЂкИљОнБэжаЪ§ОнХаЖЯT1 _________T2(ЬюЁАЃОЁБЁАЃМЁБЛђЁА=ЁБ)ЃЌЕБЮТЖШЮЊT2ЪБЗДгІНјааЕН40minЪБЃЌx_______0.15(ЬюЁАЃОЁБЁАЃМЁБЛђЁА=ЁБ)ЃЌИУЗДгІЮЊ_________(ЬюЁАЗХШШЁБЛђЁАЮќШШЁБ)ЗДгІЁЃ
ЂлЕЅЮЛЪБМфФкаЮГЩCЁЊHМќгыаЮГЩC==OбѕМќЕФЪ§ФПжЎБШЮЊ_________ЪБЃЌЫЕУїЗДгІДяЕНЦНКтзДЬЌЁЃ
ЂмЮТЖШЮЊT2ЪБЃЌШєЯрЦНКтКѓЕФШнЦїжадйГфШы0.5molCH4КЭ1.2molNO2ЃЌжиаТДяЕНЦНКтЪБЃЌn(N2)ЕФЗЖЮЇЪЧ__________________ЁЃ
(3)МзЭщЁЂввЯЉЭъШЋШМЩеОљЩњГЩCO2ЃЌГЃЮТЯТH2CO3![]() H++HCO3- Ka1=4.3ЁС10-7ЃЛHCO3-
H++HCO3- Ka1=4.3ЁС10-7ЃЛHCO3-![]() H++CO3-2- Ka2=5.6ЁС10-11ЃЛNH3ЁЄH2O
H++CO3-2- Ka2=5.6ЁС10-11ЃЛNH3ЁЄH2O![]() NH4++OH- Kb=1.8ЁС10-5ЃЛгУАБЫЎЮќЪеCO2ЩњГЩNH4HCO3ШмвКЃЌдђNH4HCO3ШмвКЯд_________(ЬюЁАЫсадЁБЁАМюадЁБЛђЁАжаадЁБ)ЃЌМЦЫуЗДгІNH4++HCO3-+H2O
NH4++OH- Kb=1.8ЁС10-5ЃЛгУАБЫЎЮќЪеCO2ЩњГЩNH4HCO3ШмвКЃЌдђNH4HCO3ШмвКЯд_________(ЬюЁАЫсадЁБЁАМюадЁБЛђЁАжаадЁБ)ЃЌМЦЫуЗДгІNH4++HCO3-+H2O![]() NH3ЁЄH2O+H2CO3ЕФЦНКтГЃЪ§K=_________(НсЙћБЃСєаЁЪ§ЕуКѓ1ЮЛ)
NH3ЁЄH2O+H2CO3ЕФЦНКтГЃЪ§K=_________(НсЙћБЃСєаЁЪ§ЕуКѓ1ЮЛ)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПюмЁЂ ЭМАЦфЛЏКЯЮядкЙЄвЕЩЯгаживЊгУЭОЃЌ ЛиД№ЯТСаЮЪЬтЃК
(1) ЧыВЙГфЭъЛљЬЌCoЕФМђЛЏЕчзгХХВМЪНЃК [Ar]_________ЃЌ Co2+га_______ИіЮДГЩЖдЕчзгЁЃ
(2) Na3[Co(NO2)6]ГЃгУзїМьбщK+ЕФЪдМСЃЌ ХфЮЛЬхNO2ЃЕФжааФдзгЕФдгЛЏаЮЪНЮЊ________ЃЌ ПеМфЙЙаЭЮЊ_____ЁЃДѓІаМќПЩгУЗћКХ![]() БэЪОЃЌ ЦфжаmДњБэВЮгыаЮГЩДѓІаМќЕФдзгЪ§ЃЌ nЮЊИїдзгЕФЕЅЕчзгЪ§(аЮГЩІвМќЕФЕчзгГ§Эт)КЭЕУЕчзгЪ§ЕФзмКЭ (ШчБНЗжзгжаЕФДѓІаМќПЩБэЪОЮЊ
БэЪОЃЌ ЦфжаmДњБэВЮгыаЮГЩДѓІаМќЕФдзгЪ§ЃЌ nЮЊИїдзгЕФЕЅЕчзгЪ§(аЮГЩІвМќЕФЕчзгГ§Эт)КЭЕУЕчзгЪ§ЕФзмКЭ (ШчБНЗжзгжаЕФДѓІаМќПЩБэЪОЮЊ![]() )ЃЌдђNO2ЃжаДѓІаМќгІБэЪОЮЊ____________ЁЃ
)ЃЌдђNO2ЃжаДѓІаМќгІБэЪОЮЊ____________ЁЃ
(3) ХфКЯЮя[Cu(En)2]SO4ЕФУћГЦЪЧСђЫсЖўввЖўАЗКЯЭ(Ђђ)ЃЌ ЪЧЭЕФвЛжжживЊЛЏКЯЮяЁЃЦфжа En ЪЧввЖўАЗ(H2NCH2CH2NH2)ЕФМђаДЁЃ
ЂйИУХфКЯЮя[Cu(En)2]SO4жаNЁЂ OЁЂ CuЕФЕквЛЕчРыФмгЩаЁЕНДѓЕФЫГађЪЧ______________ЁЃ
ЂкввЖўАЗКЭШ§МзАЗ[N(CH3)3]ОљЪєгкАЗЃЌ ЧвЯрЖдЗжзгжЪСПЯрНќЃЌ ЕЋввЖўАЗБШШ§МзАЗЕФЗаЕуИпЕУЖрЃЌ двђЪЧ______________________________________________________ЁЃ

(4) Н№ЪєCuОЇЬхжаЕФдзгЖбЛ§ЗНЪНШчЭМЫљЪОЃЌ ЦфХфЮЛЪ§ЮЊ______ЃЌ ЭЕФдзгАыОЖЮЊa nmЃЌ АЂЗќМгЕТТоГЃЪ§ЕФжЕЮЊNAЃЌ CuЕФУмЖШЮЊ_________g/cm3(СаГіМЦЫуЪНМДПЩ)ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПГЃЮТЯТЃЌ НЋЯЁ HClШмвКЕЮМгЕНЕШХЈЖШЕФШѕМю AOHШмвКжаЃЌ ВтЕУЛьКЯвКЕФ pHКЭlg[C(AOH)/C(A+)] ЕФЙиЯЕШчЭМЫљЪОЃЌ Цфжа aЕуБэЪОЮДМгбЮЫсЪБЕФЪ§ОнЃЌ eЕуБэЪО HClКЭ AOHЧЁКУЭъШЋЗДгІЪБЕФЪ§ОнЁЃЯТСаЫЕЗЈДэЮѓЕФЪЧ

A. ГЃЮТЯТЃЌ A+ЕФЫЎНтЦНКтГЃЪ§ЮЊ 1.0ЁС10Ѓ10
B. ЕуeШмвКжаЫЎЕчРыГіЕФH+ХЈЖШЮЊ 10Ѓ6.23mol/L
C. Еуc ШмвКжаЕФ n(A+)+n(AOH)ЕШгкЕу eШмвКжаЕФ n(ClЃ)
D. ЕуdШмвКжаЃК c(ClЃ)> c(AOH)>c(A+)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгУNAБэЪОАЂЗќМгЕТТоГЃЪ§ЕФжЕЁЃЯТСаа№Ъіе§ШЗЕФЪЧ( )
A. ГЃЮТГЃбЙЯТЃЌ11.2LЖўбѕЛЏСђЫљКЌЕФбѕдзгЪ§ЕШгкNA
B. 0.5molH2OЫљКЌЕФЕчзгЪ§ЮЊ9NA
C. 8.0gCu2SКЭCuOЕФЛьКЯЮяжаКЌгаЭдзгЪ§ЮЊ0.1NA
D. 300mL2molЁЄL-1есЬЧШмвКжаЫљКЌЗжзгЪ§ЮЊ0.6NA
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯжгадзгађЪ§аЁгк20ЕФAЃЌBЃЌCЃЌDЃЌEЃЌF6жждЊЫиЃЌЫќУЧЕФдзгађЪ§вРДЮдіДѓЃЌвбжЊBдЊЫиЪЧЕиПЧжаКЌСПзюЖрЕФдЊЫиЃЛAКЭCЕФМлЕчзгЪ§ЯрЭЌЃЌBКЭDЕФМлЕчзгЪ§вВЯрЭЌЃЌЧвAКЭCСНдЊЫидзгКЫЭтЕчзгЪ§жЎКЭЪЧBЃЌDСНдЊЫидзгКЫФкжЪзгЪ§жЎКЭЕФ1/2ЃЛCЃЌDЃЌEШ§жждЊЫиЕФЛљЬЌдзгОпгаЯрЭЌЕФЕчзгВуЪ§ЃЌЧвEдзгЕФpЙьЕРЩЯЕчзгЪ§БШDдзгЕФpЙьЕРЩЯЖрвЛИіЕчзгЃЛ6жждЊЫиЕФЛљЬЌдзгжаЃЌFдзгЕФЕчзгВуЪ§зюЖрЧвКЭAДІгкЭЌвЛжїзхЁЃЛиД№ЯТСаЮЪЬтЁЃ
ЃЈ1ЃЉгУЕчзгЪНБэЪОCКЭEаЮГЩЛЏКЯЮяЕФЙ§ГЬ________________ЁЃ
ЃЈ2ЃЉаДГіЛљЬЌFдзгКЫЭтЕчзгХХВМЪН__________________ЁЃ
ЃЈ3ЃЉаДГіA2DЕФЕчзгЪН________ЃЌЦфЗжзгжа________(ЬюЁАКЌЁБЛђЁАВЛКЌЁБ)ІвМќЃЌ________(ЬюЁАКЌЁБЛђЁАВЛКЌЁБ)ІаМќЁЃ
ЃЈ4ЃЉAЃЌBЃЌCЙВЭЌаЮГЩЕФЛЏКЯЮяЛЏбЇЪНЮЊ________ЃЌЦфжаЛЏбЇМќЕФРраЭга________ЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com