
【题目】SO2的含量是衡量大气污染的一个重要指标。工业上常采用催化还原法或吸收法处理SO2。利用催化还原SO2法不仅可消除SO2污染,而且可得到有经济价值的单质S。
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2和液态H2O。已知CH4和S的燃烧热(ΔH)分别为-890.3 kJ/mol和-297.2 kJ/mol,则CH4和SO2反应的热化学方程式为_________________。
(2)在恒容密闭容器中,用H2还原SO2生成S的反应分两步完成(如图1所示),该过程中相关物质的物质的量浓度随时间的变化关系如图2所示:

①分析可知X为___________(填化学式),O~t1时间段的温度为_____________,0~t1时间段用SO2表示的化学反应速率为_________________。
②用H2还原SO2生成S的总反应的化学方程式为__________________。
(3)焦炭催化还原SO2生成S2,化学方程式为2C(s)+2SO2(g)![]() S2(g)+2CO2(g),恒容密闭容器中,1 mol/L SO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
S2(g)+2CO2(g),恒容密闭容器中,1 mol/L SO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
①该反应的ΔH_______(填“>”或“<”)0。
②计算a点的平衡常数为______________。
【答案】CH4(g)+2SO2(g)===CO2(g)+2S(s)+2H2O(l)ΔH=-295.9kJ/mol H2S 300℃ 2/t1×10-3mol/(L·min) 2H2+SO2![]() S+2H2O < 36.45mol/L
S+2H2O < 36.45mol/L
【解析】
(1)根据盖斯定律进行推导CH4和SO2反应的热化学方程式;
(2)H2还原SO2发生反应2H2+SO2![]() S+2H2O,图1右侧SO2→S,S元素的化合价降低,根据氧化还原反应特点,化合价有升高,必然有降低,因此推出X为H2S;0~t1时间,X的浓度达到最大,应是图1左侧反应,4H2+SO2=H2S+2H2O,温度为300℃;根据化学反应速率的表达式进行计算;
S+2H2O,图1右侧SO2→S,S元素的化合价降低,根据氧化还原反应特点,化合价有升高,必然有降低,因此推出X为H2S;0~t1时间,X的浓度达到最大,应是图1左侧反应,4H2+SO2=H2S+2H2O,温度为300℃;根据化学反应速率的表达式进行计算;
(3)根据三段式计算a点的平衡常数。
(1)CH4燃烧的热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ/mol ①,S燃烧的热化学方程式为:S(s)+O2(g)═SO2(g),△H=-297.2kJ/mol ②,根据盖斯定律可知,由①-②×2即可得到CH4和SO2反应的热化学方程式为:CH4(g)+2SO2(g)=CO2(g)+2S(s)+2H2O(l) ΔH=-295.9kJ/mol,故答案为:CH4(g)+2SO2(g)=CO2(g)+2S(s)+2H2O(l) ΔH=-295.9kJ/mol。
(2)①H2还原SO2发生反应2H2+SO2![]() S+2H2O,图1右侧SO2→S,S元素的化合价降低,根据氧化还原反应特点,化合价有升高,必然有降低,因此推出X为H2S;0~t1时间,X的浓度达到最大,应是图1左侧反应,4H2+SO2=H2S+2H2O,温度为300℃;根据化学反应速率的表达式,v(SO2)=(3-1)/t1×10-3mol/(L·min)=2/t1×10-3mol/(L·min),故答案为:H2S,300℃,2/t1×10-3mol/(L·min)。
S+2H2O,图1右侧SO2→S,S元素的化合价降低,根据氧化还原反应特点,化合价有升高,必然有降低,因此推出X为H2S;0~t1时间,X的浓度达到最大,应是图1左侧反应,4H2+SO2=H2S+2H2O,温度为300℃;根据化学反应速率的表达式,v(SO2)=(3-1)/t1×10-3mol/(L·min)=2/t1×10-3mol/(L·min),故答案为:H2S,300℃,2/t1×10-3mol/(L·min)。
②根据以上分析,总反应的化学方程式为2H2+SO2![]() S+2H2O,故答案为:2H2+SO2
S+2H2O,故答案为:2H2+SO2![]() S+2H2O。
S+2H2O。
(2)①根据图像,700℃时SO2的转化率达到最大,反应达到平衡,右侧随着温度的升高,SO2的转化率降低,根据勒夏特列原理,正反应为放热反应,即ΔH<0,故答案为:<。
② 2C(s)+2SO2(g)![]() S2(g)+2CO2(g)
S2(g)+2CO2(g)
起始(mol/L) 1 0 0
变化(mol/L) 0.9 0.45 0.9
平衡(mol/L) 0.1 0.45 0.9
化学平衡常数的表达式K=c(S2)c2(CO2)/c2(SO2)=0.45mol/L×(0.9mol/L)2/(0.1mol/L)2=36.45mol/L
故答案为:36.45mol/L。


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】已知丁醇(C4H10O)和己烯(C6H12)组成的混合物中,其中氧元素的质量分数为8%,则氢元素的质量分数为( )
A. 13%B. 14%C. 26%D. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化铝(AlON)属于原子晶体,是一种超强透明材料,下列描述错的是( )
A.AlON和石英的化学键类型相同B.电解熔融AlON可得到Al
C.AlON的N元素化合价为﹣1D.AlON和石英晶体类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫单质及其化合物在化工生成等领域应用广泛。
(1)工业尾气中的SO2一直是环境污染的主要原因之一,工业上常采用如下方法降低尾气中的含硫量:
①方法1:燃煤中加入生石灰,将SO2转化为CaSO3,再氧化为CaSO4
已知:a. CaO(s)+CO2(g) =CaCO3(s) ΔH=-178.3kJ·mol-1
b.2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g) ΔH=-2762.2kJ·mol-1
c.2CaSO3(s)+O2(g)=2CaSO4(s) ΔH=-2314.8kJ·mol-1
写出CaO(s)与SO2(g)反应生成CaSO3(s)的热化学方程式:____________________________。
②方法2:用氢氧化钠溶液将SO2转化为NaHSO3,再氧化为 Na2SO4。实验测得NaHSO3溶液中![]() = 1500,则溶液的pH为______________(已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)。
= 1500,则溶液的pH为______________(已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)。
(2)煤制得的化工原料气中含有羰基硫(0=C=S),该物质可转化为H2S,反应为COS(g) +H2(g)![]() H2S (g)+CO(g) ΔH>0。
H2S (g)+CO(g) ΔH>0。
①恒温恒容条件下,密闭容器中发生上述反应,下列事实不能说明反应达到平衡状态的是__________(填字母)。
a.COS的浓度保持不变 b.化学平衡常数不再改变
c.混合气体的密度不再改变 d.形成2molH-S键的同时形成1mol H-H键
②T1℃时,在恒容的密闭容器中,将一定量的CO和H2S混合加热并达到下列平衡:H2S(g)+ CO(g) ![]() COS(g)+H2(g),K=0.25,则该温度下反应COS(g)+H2(g)
COS(g)+H2(g),K=0.25,则该温度下反应COS(g)+H2(g)![]() H2S(g)+ CO(g)的平衡常数K=__________。T1℃时,向容积为10 L的恒容密闭容器中充入1mol COS(g)和1molH2(g),达到平衡时COS的转化率为______________________。
H2S(g)+ CO(g)的平衡常数K=__________。T1℃时,向容积为10 L的恒容密闭容器中充入1mol COS(g)和1molH2(g),达到平衡时COS的转化率为______________________。
(3)过二硫酸(H2S2O8)是一种强氧化性酸,其结构式为
 。
。
①在Ag+催化作用下,S2O82-能与Mn2+在水溶液中发生反应生成SO42-和MnO4-,1mol S2O82-能氧化的Mn2+的物质的量为_________mol。
②工业上可用惰性电极电解硫酸和硫酸铵混合溶液制备过二硫酸铵。则阳极的电极反应式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(ClNO)常用作催化剂和合成洗涤剂,其沸点为-5.5 ℃,易水解。某学习小组在实验室中用下图所示装置制备ClNO。已知:HNO2既有氧化性又有还原性;AgNO2微溶于水,能溶于硝酸,AgNO2+HNO3===AgNO3+HNO2。
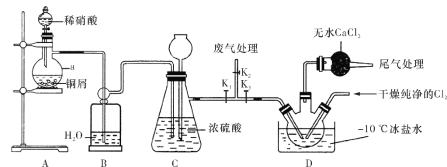
请回答下列问题:
(1)仪器a的名称为________,装置B的作用是________。
(2)装置A中发生反应的化学方程式为________。
(3)装置C中长颈漏斗的作用是________。
(4)实验开始时,先打开K1、K2,关闭K3,再打开分液漏斗活塞滴入适量稀硝酸,当观察到装置C中________时关闭K1、K2。向装置D三颈瓶中通入干燥纯净的Cl2,当瓶中充满黄绿色气体时,再打开K1、K3,制备ClNO。
(5)装置D中干燥管的作用是________。
(6)ClNO与H2O反应生成HNO2和HCl。
①设计实验证明HNO2是弱酸:________(仅提供的试剂:1 mol·L-1盐酸、1 mol·L-1 HNO2溶液、NaNO2溶液、红色石蕊试纸、蓝色石蕊试纸)。
②要验证ClNO与 H2O 反应后的溶液中存在Cl-和HNO2,合理的操作步骤及正确的顺序是________(填字母代号)。
a.向烧杯中滴加过量KI淀粉溶液,溶液变蓝色
b.取1.0 mL ClNO加入到盛有10.0 mL H2O的烧杯中,充分反应
c.向烧杯中滴加酸性KMnO4溶液,溶液紫红色褪去
d.向烧杯中滴加足量AgNO3溶液,有白色沉淀生成,加入稀硝酸,搅拌,仍有白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)是一种无色晶体,易溶于水,微溶于乙醇,不溶于乙醚,广泛应用于汽车安全气囊。某硝酸工厂拟通过下列方法处理尾气并制备叠氮化钠。

(1)NO和NO2混合气体与NaOH溶液反应可以合成NaNO2,写出该反应的化学方程式___,生成1mol NaNO2时转移电子______mol
(2)已知NaN3阳离子与阴离子个数比为1:1,则NaN3中所含的化学键为______和______,1mol该阴离子中所含的电子总数为______mol
(3)汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3![]() K2O+5Na2O+16N2↑。假定汽车中某个安全气囊容积为56 L。
K2O+5Na2O+16N2↑。假定汽车中某个安全气囊容积为56 L。
①该反应中的氧化剂为______还原剂为______(填化学式)
②欲使气囊中充满标准状况下氮气,则该安全气囊中生成的K2O和Na2O的总质量为多少克______?(写出计算过程,保留一位小数,不考虑固体的体积)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气吹出法工艺是目前“海水提溴”的最主要方法之一。其工艺流程如图所示,其中不正确的是

A.步骤④⑤是为了富集溴
B.步骤③说明溴具有挥发性
C.步骤④的离子方程式为Br2+SO2+H2O![]() 2H++2Br-+SO32-
2H++2Br-+SO32-
D.步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物可用分液漏斗分离
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com