
【题目】焦亚硫酸钠(Na2S2O5)是一种食品添加剂。实验室用如图所示装置制备Na2S2O5,实验步骤如下:

Ⅰ.向Na2CO3溶液中通入SO2至溶液pH为4.1,生成NaHSO3溶液;
Ⅱ.加入碳酸钠粉末至溶液PH为7~8;
Ⅲ.再通入SO2至溶液PH为4.1;
Ⅳ.从过饱和溶液中析出Na2S2O5晶体。
(1)制备焦亚硫酸钠总反应的化学方程式为___________________ 。
(2)Na2S2O5能与水发生化合反应,反应后所得的溶液显酸性。用电离方程式表示溶液显酸性的原因:____________________。
(3)利用碘量法可测定Na2S2O5产品中硫的含量。实验中必须使用的试剂有c1mol·L-1的标准碘溶液、c2 mol·L-1的标准Na2S2O3溶液、NaOH溶液、淀粉溶液。已知:Na2S2O5+2I2+3H2O=Na2SO4+H2SO4+4HI,2Na2S2O3+I2= Na2S2O6+2NaI。请补全实验方案:将一定量的Na2S2O5产品放入碘量瓶(带磨口塞的锥形瓶)中,加入—定体积的过量c1 mol L-1的标准碘溶液,充分反应后滴入NaOH溶液调节溶液pH至中性,____________________________。重复上述步骤2次,记录数据。
(4)含铬酸性废水中常含有+ 6价铬。利用Na2S2O5和FeSO4·7H2O分两个阶段先后处理含Cr2O72-的废水, Cr2O72-被还原为Cr3+,实验结果如图。

①0~40 min内用Cr2O72-表示的平均反应速率为____________mol L-1 min-1。
②60~80 min内Cr2O72-与Fe2+发生反应的离子方程式为_________________ 。
【答案】 Na2CO3+2SO2=Na2S2O5+CO2 NaHSO3=Na++HSO3-、HSO3-![]() H++SO32-(只写 HSO3-
H++SO32-(只写 HSO3-![]() H++S O32-也给分) 加入淀粉溶液,用c2mol L-1的标准Na2SO3溶液滴定至溶液由蓝色恰好变为无色,且半分钟内不变色,读数 1.75×10-3 Cr2O72-+ 6Fe2++14H+=2Cr3++6Fe3++7H2O
H++S O32-也给分) 加入淀粉溶液,用c2mol L-1的标准Na2SO3溶液滴定至溶液由蓝色恰好变为无色,且半分钟内不变色,读数 1.75×10-3 Cr2O72-+ 6Fe2++14H+=2Cr3++6Fe3++7H2O
【解析】(1)Na2CO3和SO2反应生成Na2S2O5和CO2,根据元素守恒可知化学方程式为:Na2CO3+2SO2=Na2S2O5+CO2;(2)Na2S2O5与水反应生成NaHSO3,NaHSO3在水中电离程度大于水解程度,所以使溶液显酸性:NaHSO3=Na++HSO3-、HSO3-![]() H++SO32-;(3)根据氧化还原滴定原理,在Na2S2O5溶液中加入过量的标准碘溶液,使Na2S2O5被充分氧化,剩余的标准碘溶液再用标准Na2S2O5溶液滴定,根据加入的碘的总量和与Na2S2O5溶液反应的碘的量可以求得与Na2S2O5反应的碘的量,进而确定Na2S2O5的量,根据这一原理可知实验操作步骤为:将一定量的Na2S2O5产品放入碘量瓶(带磨口塞的锥形瓶)中,加入—定体积的过量c1 mol L-1的标准碘溶液,充分反应后滴入NaOH溶液调节溶液pH至中性,加入淀粉溶液,用c2mol L-1的标准Na2SO3溶液滴定至溶液由蓝色恰好变为无色,且半分钟内不变色,读数,重复上述步骤2次,记录数据;(4)①0~40 min内Cr2O72-的浓度变化量为:0.08mol/L-0.01mol/L=0.07mol/L,则平均反应速率为
H++SO32-;(3)根据氧化还原滴定原理,在Na2S2O5溶液中加入过量的标准碘溶液,使Na2S2O5被充分氧化,剩余的标准碘溶液再用标准Na2S2O5溶液滴定,根据加入的碘的总量和与Na2S2O5溶液反应的碘的量可以求得与Na2S2O5反应的碘的量,进而确定Na2S2O5的量,根据这一原理可知实验操作步骤为:将一定量的Na2S2O5产品放入碘量瓶(带磨口塞的锥形瓶)中,加入—定体积的过量c1 mol L-1的标准碘溶液,充分反应后滴入NaOH溶液调节溶液pH至中性,加入淀粉溶液,用c2mol L-1的标准Na2SO3溶液滴定至溶液由蓝色恰好变为无色,且半分钟内不变色,读数,重复上述步骤2次,记录数据;(4)①0~40 min内Cr2O72-的浓度变化量为:0.08mol/L-0.01mol/L=0.07mol/L,则平均反应速率为![]() =1.75×10-3molL-1min-1;②Cr2O72-与Fe2+在H+作用下生成Cr3+、Fe3+和H2O,反应的离子方程式为:Cr2O72-+ 6Fe2++14H+=2Cr3++6Fe3++7H2O。
=1.75×10-3molL-1min-1;②Cr2O72-与Fe2+在H+作用下生成Cr3+、Fe3+和H2O,反应的离子方程式为:Cr2O72-+ 6Fe2++14H+=2Cr3++6Fe3++7H2O。


科目:高中化学 来源: 题型:
【题目】关于氰酸铵(NH4CNO)与尿素[CO(NH2)2]的说法正确的是 ( )
A. 都是含极性键的共价化合物 B. 都是含非极性键的离子化合物
C. 互为同分异构体 D. 互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~H都是初中化学中常见的物质,已知B为黑色固体,D为红色固体单质,F为红色固体,H溶液中的溶质是一种盐.它们的转化关系如图所示.请回答:
(1)物质B、E和F的化学式为B、E、F;
(2)反应①的化学方程式为: , 其反应类型为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 25℃时,等物质的量浓度、等体积的NH4HSO4溶液和NaOH溶液混合:
c(Na+)=c(SO4-)>c(NH4+)>c(H+)>c(OH-)
B. 25℃时,0.1mol L-1的HA溶液中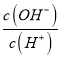 = 1×10-8,则该溶液中由水电离出的c(H+)=l×10-3mol·L-1
= 1×10-8,则该溶液中由水电离出的c(H+)=l×10-3mol·L-1
C. 25℃时,对于pH相同的弱碱ROH和MOH(前者的电离平衡常数Kb较小),加水稀释后溶液的pH仍相同,则后者稀释的倍数更大
D. 25℃时,沉淀溶解平衡:BaSO4(s)![]() Ba2+(aq)+SO42-(aq)的Ksp为1.1×10-10,说明BaSO4是弱电解质
Ba2+(aq)+SO42-(aq)的Ksp为1.1×10-10,说明BaSO4是弱电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸碱指示剂是一种有机弱酸,其在水溶液中呈现的颜色与其电离平衡相关:HA(红色)![]() H++A-(黄色),若要使该指示剂呈黄色,则应加入
H++A-(黄色),若要使该指示剂呈黄色,则应加入
A. H2SO4 B. HCl C. NaOH D. NaHSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若1摩尔C2H2气体完全燃烧生成液态水和CO2气体时放热1299kJ,则乙炔的燃烧热__________热化学方程式是____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如右图所示。下列分析不正确的是( )

A. ①代表滴加H2SO4溶液的变化曲线
B. b点,溶液中大量存在的离子是Na+、OH–
C. c点,两溶液中含有相同量的OH–
D. a、d两点对应的溶液均显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,判断下列叙述中正确的是

A.每生成2分子AB吸收b kJ热量
B.该反应热ΔH=-(a-b) kJ·mol-1
C.该反应中生成物的总能量高于反应物的总能量
D.断裂1 mol A—A和1 mol B—B键,放出a kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与科技、社会、生产密切结合,下列有关说法不正确的是( )。
A.“乙醇汽油”的广泛使用能有效减少有害气体的排放
B.“无磷洗涤剂”的推广使用,能有效减少水体富营养化的发生
C.“无氟冰箱”取代“含氟冰箱”,对人类的保护伞——臭氧层起到保护作用
D.“海水淡化”可以解决“淡水供应危机”,向海水中加入净水剂明矾可以使海水淡化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com