
【题目】下列物质能与溴水发生化学反应并使溴水褪色的是
A.乙醇B.乙烯C.苯D.甲烷
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】若NA表示阿伏加德罗常数,下列说法中,正确的是( )
A. 1 mol Cl2作为氧化剂得到的电子数为NA
B. 在0 ℃,101 kPa时,22.4 L氢气中含有NA个氢原子
C. 25 ℃,1.01×105Pa,64 g SO2中含有的原子数为3NA
D. 将0.1 mol FeCl3加到沸水中制得的胶体中,含胶粒0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,取0.1mol/L的NaA和NaB两种盐溶液各1L,分别通入0.02molCO2,发生如下反应:NaA+CO2+H2O=HA+NaHCO3、2NaB+CO2+H2O=2HB+Na2CO3。HA和HB的1L溶液分别加水稀释至体积为VL时可能有如图曲线,则下列说法正确的是
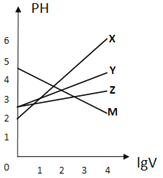
A. 相同条件下,对于c(R-)/[c(HR)·c(OH-)]的值(R代表A或B),一定存在HA>HB
B. 常温下pH:NaA溶液>NaB溶液
C. X是HA,M是HB
D. 若常温下浓度均为0.1mol/L的NaA和HA的溶液等体积混合,则c(A-)+c(HA)=0.2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】你认为减少酸雨的产生可采取的措施是( )
①用煤作燃料 ②把工厂烟囱造高 ③化石燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源.
A.①②③
B.②③④⑤
C.③⑤
D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钠是日常生活的必需品,也是重要的化工原料。
(1)粗盐除含NaCl外,还含有少量MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是粗盐提纯的操作流程。

提供的试剂:
Na2CO3溶液、K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、饱和NaCl溶液。
①欲除去溶液I中的MgCl2、CaCl2、Na2SO4,从提供的试剂中选出a所代表的试剂,按滴加顺序依次为:过量的NaOH溶液、_____________、_____________;
②用离子方程式表示加盐酸的作用是________________;_______________________;
(2)实验所得纯NaCl的质量大于粗盐中NaCl的质量,原因是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子反应、氧化还原反应都是中学化学中重要的反应类型。请回答下列问题:
(1)在发生离子反应的反应物或生成物中,一定存在有_____________。
A.单质 B.氧化物 C.电解质 D.盐 E.化合物
(2)人们常用图示的方法表示不同反应类型之间的关系。如分解反应和氧化还原反应可表示为下图。右图为离子反应、氧化还原反应和置换反应三者之间的关系,则表示离子反应、氧化还原反应、置换反应的字母依次是_____________

(3)将NaBr溶液加入AgC1沉淀中,产生AgBr黄色沉淀。从离子反应发生的条件分析,AgCl与AgBr相比较,溶解度较大的是_____________。
(4)已知某氧化还原反应Au2O3 + 4Na2S2O3 + 2H2O =Au2O+ 2Na2S4O6 +4NaOH
① 用单线桥标出电子转移的方向和数目________________。
② 反应中,被氧化的元素是______________,氧化剂是_________________。
③ 比较该反应中氧化剂和氧化产物的氧化性相对强弱_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要90 mL 3.0mol·L-1 稀硫酸溶液,某同学用质量分数为98%,密度为1.84g/cm3的浓硫酸配制。实验操作如下:
A.将配好的稀硫酸倒入试剂瓶中,贴好标签;
B.盖好容量瓶塞,反复颠倒,摇匀;
C.用量筒量取 mL98%的浓硫酸;
D.将______________沿烧杯内壁慢慢注入盛有少量______________的烧杯中;
E.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液也全部转移到容量瓶中;
F.将已冷却至室温的硫酸溶液沿玻璃棒注入 ;
G.改用 逐滴加蒸馏水,使溶液凹面恰好与刻度相切;
H.继续向容量瓶中加蒸馏水,直到液面接近刻度线1~2 cm处。
(1)填写上述步骤中的空白:
C:________ ;D :将________ 注入________ ;F:________ ;G:_______ 。
(2)将上面操作步骤按正确的进行排序______________(用字母表示)。
(3)试分析下列操作会使所配溶液的浓度偏高的是______________(填序号)。
① 量取浓硫酸时俯视读数;
② 转移溶液前,容量瓶中含有少量蒸馏水;
③ 溶解硫酸用的烧杯、玻璃棒未洗涤;
④ 未冷却至室温定容;
⑤ 定容时俯视容量瓶的刻度线;
⑥ 定容后摇匀,发现液面低于刻度线,再滴加蒸馏水至刻度线。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关说法正确的是( )
A. 46g乙醇中含有的共价键总数为7NA
B. FeBr2与等物质的量的Cl2充分反应时转移的电子数为3NA
C. 标准状况下,2.24LCHCl3中含有0.3NA个氯原子
D. 常温常压下,2.0g重水(D2O)中含有NA个中子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com