
将碱溶液A、盐溶液B按如下程序进行实验,根据下述现象判断: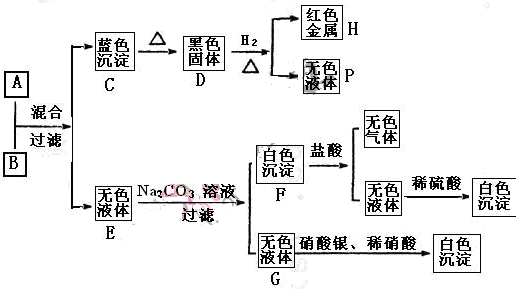
(1)A的化学式 B的化学式 。
(2)完成下列转化的化学方程式,并用“单线桥法”标明电子转移的方向和数目:
D+H2=H+P:
(3) 写出下列反应的离子方程式:
A+B:
F+盐酸:
(4)盐溶液B中阴离子的检验方法是
(1)Ba(OH)2 CuCl2
(2)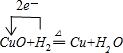
(3)Cu2++2OH-=Cu(OH)2↓ Ba CO3+2H+=Ba 2++CO2↑+H2O
(4)取少量B溶液于试管中,滴加硝酸银溶液产生白色沉淀,再滴加稀硝酸沉淀不溶解。
解析试题分析:由转化关系图知,H为红色金属,则H为Cu,采用逆推法,D为黑色固体CuO,C为蓝色沉淀Cu(OH)2,P为H2O;采用正推法,碱溶液A+盐溶液B→Cu(OH)2+无色溶液E,B为铜盐,由无色溶液E加Na2CO3溶液,过滤得无色溶液G,加硝酸银和稀硝酸产生白色沉淀,故G为氯化钠,无色溶液E含有Cl-,故盐溶液B为CuCl2;由无色溶液E加Na2CO3溶液,过滤得白色沉淀F,加盐酸产生无色气体和无色溶液,白色沉淀F为碳酸盐,该无色溶液加硫酸产生白色沉淀,故无色溶液含有Ba2+,故白色沉淀为BaCO3,无色溶液E含有Cl-,故E为BaCl2,再结合碱溶液A+盐溶液B→Cu(OH)2+无色溶液E,故A为Ba(OH)2。
(1)由上述分析可知,A为Ba(OH)2;B为CuCl2;(2)D+H2→H+P为: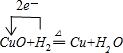 ;
;
(3)A+B反应是氢氧化钡与氯化铜反应生成氢氧化铜与氯化钡,反应离子方程式为:Cu2++2OH-=Cu(OH)2↓;F+盐酸是碳酸钡与元素反应生成氯化钡、二氧化碳与水,反应离子方程式为:BaCO3+2H+=Ba2++CO2↑+H2O;(4)CuCl2溶液中阴离子的检验方法是:取少量B溶液于试管中,滴加硝酸银溶液产生白色沉淀,再滴加稀硝酸沉淀不溶解,说明含有Cl-。
考点:以无机框图题的形式考查C、Cu、Cl、S等元素单质及其化合物之间的相互转化关系、离子检验。


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:填空题
在下图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,G的水溶液是一种常用的漂白剂,F是地壳中含量最多的金属元素。(反应中生成的水和部分反应条件未列出)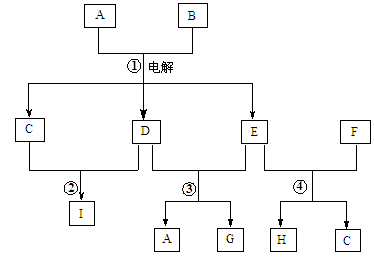
(1)画出A中阴离子的结构示意图 。
(2)反应②在点燃条件下的现象是 。
(3)H转化为F的氢氧化物最好选择的试剂是 。
(4)反应③的离子方程式为 。
(5)反应④的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
中学常见化学反应方程式为:A+B→X+Y+H2O(未配平,反应条件略去),其中,A、B的物质的量之比为1:4。请回答:
(1)若Y为黄绿色气体,该反应的离子方程式为 ,B体现出的化学性质有
(2)若A为常见的非金属单质,B的溶液为某浓酸,反应条件为加热,其反应的化学方程式为
(3)若A为某不活泼的金属单质,实验室常用该反应来制备某种能形成酸雨的气体,该反应中氧化剂与还原剂的物质的量之比为
(4)若A为常见的金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中。
①A元素在元素周期表中的位置是
②含amolX的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的X的物质的量是
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如下图表示有关物质之间的转化关系,其中X是一种正盐,Y是一种强酸,C是淡黄色固体,E是常见的金属单质.(反应①⑥⑦⑧⑨中的部分产物已略去).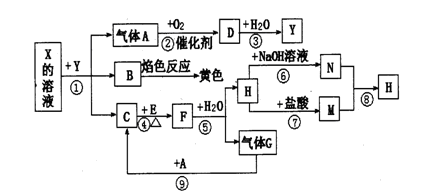
请回答下列问题:
(1)固体C的晶体类型是 ,F的化学式是 。
(2)工业上要实现A—D D—Y的转化需要的设备分别是 、 。
(3)在反应⑨中的氧化剂与还原剂的物质的量之比是 。
(4)反应⑧的离子方程式为 。
(5)正盐X中酸根离子中除氧元素外另一种元素的平均化合价可能为( )。
| A.+4价 | B.-2价 | C. 0价 | D.+2价 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A+B→X+Y+H2O(未配平,反应条件略去)是中学常见反应的化学方程式,其中A、B的物质的量之比为1:4。请回答:
(1)若Y是黄绿色气体,则该反应的离子方程式是 _____________________________;将Y与等物的量的SO2充分混合后通入品红溶液,未见其褪色,原因是__________________________________________(请用化学方程式解释说明)。
(2)若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,B的溶
液为某浓酸,则反应所得的氧化产物的化学式为 。
(3)若A为金属单质,常温下A在B的浓溶液中“钝化”,而且A可溶于X溶液中:
① A元素的元素符号为 ,则A与B的反应中氧化剂与还原剂的物质的量之比是 。
② 若含a mol X的溶液溶解了一定量A后,此时溶液中两种金属阳离子的物质的量恰好相等,则被还原的X的物质的量为 mol(用含a代数式表示);为保证A与B充分反应后最终所得的溶液中同时含有上述两种金属阳离子,则此时B与A的质量比应满足的取值范围是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件及部分产物未列出)。
(1)若A是常见金属单质,与B的水溶液反应生成C和D。D、F是气体单质,D在F中燃烧时发出苍白色火焰。则F所对应的元素在周期表位置是 ;反应②(在水溶液中进行)的离子方程式为 。
(2)若A、D为短周期元素组成的固体单质,A为金属,D为非金属。且③④两个反应都有红棕色气体生成,则反应①、④的化学方程式分别为
① ;④ 。
(3)若A、D、F都是短周期非金属单质,且A、D所含元素同主族,A、F所含元素同周期,C是一种能与血红蛋白结合的有毒气体;则物质B的晶体类型是 ,分子E的结构式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知A、B、D为中学常见的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物。其中,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体;丁是一种高能燃料,其组成元素与丙相同,1 mol丁分子中不同原子的数目比为1:2,且含有18 mol电子;戊是一种难溶于水的白色胶状物质,既能与强酸反应,也能与强碱反应,具有净水作用。各物质间的转化关系如下图所示(某些条件已略去)。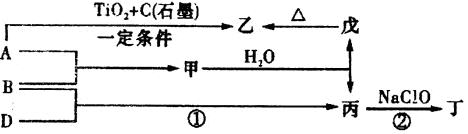
请回答:.
(1)单质B的组成元素在周期表中的位置是 。
(2)戊的化学式为 。戊与强碱反应的离子方程式: 。
(3)NaClO的电子式为 。
(4)甲与水反应的化学方程式为 。
(5)反应②中,0.5molNaClO参加反应时,转移1mol电子,其化学方程式为: 。
(6)一定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分。已知该反应生成1mol乙时放出536 kJ热量,其热化学方程式为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下列实验流程图中,X为第三周期两种重要单质的氧化物的混合物。反应②、④是工业上的重要反应,部分物质及反应条件没有列出。
请回答下列问题:
(1)写出A、E、B的化学式:A________, E___________,B___________。
(2)写出C溶液转化为C固体的过程中,HCl气流的作用:________________________。
(3)写出①、③、④反应的化学方程式,(若是离子反应写离子方程式)
①__________________________________________________;
③__________________________________________________;
④__________________________________________________。
(4)将SO2气体分别通入下列溶液写出对应的实验现象
①BaCl2溶液________________________________;
②Ba(NO3)2溶液_____________________________________;
⑨FeCl3溶液_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列依据相关实验得出的结论正确的是 ( )
| A.将(NH4)2SO4、CuSO4溶液分别加入蛋白质溶液,都出现沉淀,表明二者均可使蛋白质变性 |
| B.过量的铜屑与稀硝酸反应停止后,再加入1 mol/L稀硫酸,铜屑又逐渐溶解,且有无色气体产生,铜可直接与1 mol/L稀硫酸反应 |
| C.将常温下呈气态的某有机物通入溴水中,溴水褪色,该气体分子中一定含碳碳双键或碳碳三键 |
| D.向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com