
【题目】无机化合物在化工生产和科学研究中发挥着重要的作用。根据题意完成下列计算:
(1)一定温度下,将60mLCO、CO2与O2的混合气体用电火花引燃,完全反应后冷却到原来温度,体积减少了10mL。将反应后的气体通过足量的NaOH(aq),体积又减少了30mL。剩余气体可使带余烬的木条复燃。原混合气中CO的体积为___mL,CO2的体积为___mL。
(2)标准状况下CO与CO2混合气体的平均相对分子质量为32。将该气体完全通入盛有足量Na2O2的容积为2.24升的密闭容器中(忽略固体物质的体积),引燃,完全反应后,容器内固体生成物的质量为___g。
(3)将Fe2O3溶于150mL稀H2SO4中,待Fe2O3完全溶解后,加入铁粉,产生气体3.36L(标准状况),溶液中不再有Fe和Fe3+。已知加入的铁粉和氧化铁共19.2g,计算:
①Fe2O3的质量为(_____)g;
②稀H2SO4物质的量浓度为(_____)。
(4)取5.64gCu(NO3)2无水晶体,强热使其分解,得到NO2、O2和2.32固体氧化物。将气体用水充分吸收后,还有气体剩余,同时得到100mL溶液。请通过计算确定所得溶液的物质的量浓度(_____)(写出计算过程)
【答案】20mL 10mL 10.6 8g c(H2SO4)≥2mol/L 0.6mol/L
【解析】
(1)根据气体体积减少的量得出混合气体中CO和CO2的体积;
(2) 设混合气体中CO为xmol,CO2为ymol,由M=![]() =32可知x:y=3:1,混合气体的物质的量为:
=32可知x:y=3:1,混合气体的物质的量为:![]() =0.1mol,根据方程式计算生成物碳酸钠的物质的量,进一步计算其质量;
=0.1mol,根据方程式计算生成物碳酸钠的物质的量,进一步计算其质量;
(3)①溶液中不再有Fe和Fe3+,则反应后溶液中溶质为FeSO4,生成氢气为![]() =0.15mol,设Fe、氧化铁的物质的量分别为xmol、ymol,则根据二者质量,可得:56x+160y=19.2,反应过程中Fe化合价由0价升高为+2价失电子,Fe3+由+3价降为+2价得电子,H+得电子生成H2,根据电子转移守恒可知Fe失电子数= Fe3+得电子数+H+得电子数,计算出氧化铁的物质的量,进一步计算其质量;
=0.15mol,设Fe、氧化铁的物质的量分别为xmol、ymol,则根据二者质量,可得:56x+160y=19.2,反应过程中Fe化合价由0价升高为+2价失电子,Fe3+由+3价降为+2价得电子,H+得电子生成H2,根据电子转移守恒可知Fe失电子数= Fe3+得电子数+H+得电子数,计算出氧化铁的物质的量,进一步计算其质量;
②反应后溶液中溶质为FeSO4,若H2SO4恰好完全反应,据质量守恒知计算硫酸的物质的量,代入公式计算硫酸的浓度;
(4)NO2、O2通入水中发生4NO2+O2+2H2O=HNO3,如二者恰好反应,则生成固体为CuO,气体剩余,应为氧气,由元素化合价升降总数相等可知,Cu元素化合价降低,还应生成Cu2O,则剩余固体可能为CuO和Cu2O的混合物或Cu2O,N元素全被以NO2气体生成,通入水中发生4NO2+O2+2H2O=HNO3,根据方程式计算硝酸的物质的量,进一步求其浓度。
(1)一定温度下,将60mLCO、O2、CO2的混合气体用电火花引燃,完全反应后冷却到原来温度,体积减少了10mL,则设CO的物质的量为xmol,O2的物质的量为ymol,那么:
2CO +O2 ![]() 2CO2 体积减少ΔV
2CO2 体积减少ΔV
![]()
![]()
![]()
x=![]() =20mL,y=
=20mL,y=![]() =10mL
=10mL
生成的气体再通过NaOH溶液,二氧化碳被吸收,体积剩余60mL-10mL-30mL=20mL,说明燃烧中有气体剩余,剩余气体可使带余烬的木条复燃,则剩余的气体是O2,则混合气体中O2体积为20mL+10mL=30mL,CO为20mL,CO2体积为60mL-30mL-20mL=10mL;
(2)混合气体的平均摩尔质量为:M=32g/mol,设混合气体中CO为xmol,CO2为ymol,由M=![]() =32可知x:y=3:1,混合气体的物质的量为:
=32可知x:y=3:1,混合气体的物质的量为:![]() =0.1mol,所以
=0.1mol,所以
n(CO)=0.075mol,n(CO2)=0.025mol,将2CO+O2=2CO2、2CO2+2Na2O2=2Na2CO3+O2相加可得CO + Na2O2= Na2CO3,由方程式关系可知:
CO + Na2O2 = Na2CO3
0.075mol 0.075mol
2CO2 + 2Na2O2 = 2Na2CO3 + O2
0.025mol 0.025mol
所以n(Na2CO3)=0.075mol+0.025mol=0.1mol,则完全反应后,容器内固体生成物的质量为0.1mol×106g/mol=10.6g;
(3)①溶液中不再有Fe和Fe3+,则反应后溶液中溶质为FeSO4,生成氢气为![]() =0.15mol,设Fe、氧化铁的物质的量分别为xmol、ymol,则根据二者质量,可得:56x+160y=19.2,反应过程中Fe化合价由0价升高为+2价失电子,Fe3+由+3价降为+2价得电子,H+得电子生成H2,根据电子转移守恒可知Fe失电子数= Fe3+得电子数+H+得电子数,则:2x=2y+0.15×2,联立方程,解得x=0.2,y=0.05,故m(Fe2O3)=0.05mol×160g/mol=8g;
=0.15mol,设Fe、氧化铁的物质的量分别为xmol、ymol,则根据二者质量,可得:56x+160y=19.2,反应过程中Fe化合价由0价升高为+2价失电子,Fe3+由+3价降为+2价得电子,H+得电子生成H2,根据电子转移守恒可知Fe失电子数= Fe3+得电子数+H+得电子数,则:2x=2y+0.15×2,联立方程,解得x=0.2,y=0.05,故m(Fe2O3)=0.05mol×160g/mol=8g;
②反应后溶液中溶质为FeSO4,若H2SO4恰好完全反应,据质量守恒知:n(H2SO4)=n(FeSO4)=n(Fe)+2n(Fe2O3)=0.2mol+0.05mol×2=0.3mol,则稀H2SO4物质的量浓度为![]() =2mol/L,H2SO4有可能过量,则c(H2SO4)≥2mol/L;
=2mol/L,H2SO4有可能过量,则c(H2SO4)≥2mol/L;
(4)NO2、O2通入水中发生4NO2+O2+2H2O=HNO3,如二者恰好反应,则生成固体为CuO,气体剩余,应为氧气,由元素化合价升降总数相等可知,Cu元素化合价降低,还应生成Cu2O,则剩余固体可能为CuO和Cu2O的混合物或Cu2O,N元素全被以NO2气体生成,通入水中发生4NO2+O2+2H2O=HNO3,n(HNO3)=n(NO2)=2n[Cu(NO3)2]= ![]() =0.06mol,所得溶液的物质的量浓度c(HNO3)=
=0.06mol,所得溶液的物质的量浓度c(HNO3)= ![]() =0.6mol/L。
=0.6mol/L。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】稀土元素(铈等金属)是重要的战略资源,在工业中有重要的应用,我国著名的化学家徐光宪因建立了稀土串级萃取理论,被誉为“中国稀土之父”。
(1)完成并配平下列反应的离子方程式:______Ce3+______H2O2+______H2O→______Ce(OH)4↓+____________。
(2)氧的原子核外共有______个电子亚层,H2O 的空间构型为______;
(3)若反应中有 52g Ce(OH)4 生成,则转移电子的数目为______;
(4)实验室中进行萃取实验时,除玻璃棒、烧杯之外,还需要的玻璃仪器名称______;
(5)取上述反应得到的 Ce(OH)4 样品 0.500g,加硫酸溶解后,用 0.100molL-1 FeSO4 标准溶液滴定至终点时(铈被还原为 Ce3+),消耗 20.00 mL 标准溶液。该样品中 Ce(OH)4的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,反应物和生成物均为气体的某反应,反应过程中浓度变化如图(Ⅰ)所示。若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是( )
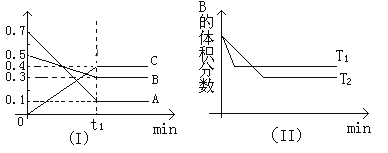
A.在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动
B.在(t1+10)min时,保持压强不变,通入稀有气体,平衡逆反应方向移动
C.T℃时,在相同容器中,若由0.1mol·L-1A、0.3mol·L-1B和0.4mol·L-1C反应,达到平衡后,C的浓度仍为0.4mol·L-1
D.在其他条件不变时,升高温度,正、逆反应速率均增大,且A的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人体必需元素,是合成血红素的重要原料,缺铁会造成贫血,市场上常见补血剂有硫酸亚铁、富马酸亚铁(分子式C4H2O4Fe)、葡萄糖酸亚铁、琥珀酸亚铁(速力菲片)等。某化学兴趣小组通过实验对硫酸亚铁补血剂成分进行探究并测定Fe2+的含量,可供选择的试剂有双氧水、KSCN溶液、盐酸、BaCl2溶液(已知KSCN可被双氧水氧化)。
(1)成分探究:小组成员发现硫酸亚铁补血剂外面糖衣是红色的,里面是淡蓝绿色的,甲同学对其组成进行如下探究:
实验探究 | 实验操作及现象 | 结论分析 |
探究一 | 将淡蓝绿色粉末溶解于盐酸溶液中,取上清液2份, ①1份滴加BaCl2溶液,产生白色沉淀,再加盐酸,无明显变化。 ②另1份溶液先滴加KSCN溶液,无明显变化,再滴加双氧水,后滴加___溶液,变成血红色。 | 证明淡蓝绿色粉末为FeSO4 |
探究二 | 将红色物质研成粉末,滴加盐酸,无明显变化,再滴加KSCN溶液,无明显现象。 | 证明:红色物质不是Fe2O3 |
(2)配制硫酸亚铁补血剂的待测溶液。
①补血剂(1片0.5克)![]() 浊液
浊液![]() 滤液
滤液![]() 配成1L待测液
配成1L待测液
步骤③浊液脱色后进行___(填标号)操作才能得到溶液。
A. B.
B.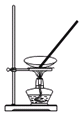
C.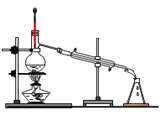 D.
D.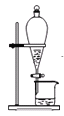
②甲同学认为步骤③滤液直接蒸发结晶不能得到硫酸亚铁晶体,理由是___,你的方案是___。
③已知步骤④中加入足量的H2O2溶液,作用是___,然后微热并用玻璃棒搅拌至无气泡产生,目的是___。
④写出步骤④中发生反应的离子方程式:___。
(3)测定硫酸亚铁补血剂待测液的浓度
方法一:用紫外分光光度法:使用紫外分光光度计,将不同波长的光连续地照射到一定标准浓度滴加5mL0.2molL-1苯二甲酸氢钾缓冲液的硫酸亚铁标准溶液,得到与不同波长相对应的吸收强度,以硫酸亚铁标准溶液的浓度为横坐标,吸光度为纵坐标,绘出该物质的吸收光谱曲线如图。
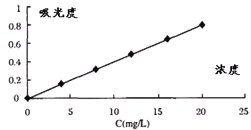
⑤取待测液10mL滴加5mL0.2molL-1苯二甲酸氢钾缓冲液,并稀释至60mL,用紫外分光光度法测得待测液的吸光度为0.4,则样品中铁元素的质量分数是___。
方法二:KMnO4标准溶液滴定法:称取4.0g的硫酸亚铁产品,溶于水,加入适量稀硫酸,用0.2molL-1KMnO4溶液滴定,当溶液中Fe2+全部被氧化时,消耗KMnO4溶液体积10.00mL。
⑥KMnO4溶液置于___式滴定管中,终点的颜色变化:___。
⑦要达到好的治疗效果,服用补血剂时需注意口服铁剂应同时并服维生素C,理由是 ___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁制品经常进行烤蓝处理,即在铁制品的表面生成一层致密的Fe3O4。某学习小组为了研究烤蓝铁片,分别进行了以下实验操作:
①把一定量烤蓝铁片加工成均匀粉末;
②取m g该粉末,放入28.00 mL 1 mol·L-1的盐酸中,恰好完全反应,生成标准状况下的气体134.4 mL,向溶液中滴入KSCN溶液,无明显现象。
完成下列各题:
(1)将反应后的溶液稀释至100 mL,则溶液中c(Fe2+)=________mol·L-1。
(2)样品中n(Fe)∶n(Fe3O4)=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数(NA)的数值,下列说法正确的是
A.1mol硫酸钾中阴离子所带电荷数为NA
B.乙烯和环丙烷(C3H6)组成的28g混合气体中含有3NA 个氢原子
C.将0.1mol氯化铁溶于1L水中,所得溶液含有0.1NA个Fe3+
D.标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )

A. 最简单气态氢化物的热稳定性:R>Q
B. 最高价氧化物对应水化物的酸性:Q<W
C. 原子半径:T>Q>R
D. 简单离子半径:T>R
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L 密闭容器中充有2 mol SO2和一定量的O2,发生下列反应2SO2+O22SO3,假设反应过程中温度恒定,当反应进行到4 min时,测得SO2为0.4 mol,若反应进行到2 min时,密闭容器中SO2的物质的量为
A. 1.6 mol B. 1.2 mol C. 大于1.6 mol D. 小于1.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如右图所示,电解总反应为:2Cu+H2O![]() Cu2O+H2↑。下列说法正确的是
Cu2O+H2↑。下列说法正确的是

A. 铜电极发生还原反应 B. 石墨电极上产生氢气
C. 铜电极接直流电源的负极 D. 当有0.1 mol电子转移时,有0.1 mol Cu2O生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com