
����Ŀ����Ҫ��������и�С��
��1��25��Cʱ��0.1 mol��L��1NH4Cl��Һ��pH____7(�����������������)����ԭ����_________(�����ӷ���ʽ��ʾ)��
��2�����������ܵ��������ڵ���ʵ���________(�����)��
A.�� B.���� C.�Ȼ��ƾ��� D.������������
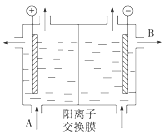
��3�����������ӽ���Ĥ����ⱥ��ʳ��ˮ��NaOH���乤��ԭ������ͼ��ʾ��
����д��A��B�������ʵ����ƣ�A_______________��B__________________��
����д�����ʳ��ˮ�����ӷ���ʽ__________________________________________��
��4���ϳɰ������Ĵ����������˹��̵�����Ҫ;�������о�������ȷ������ָ�����ϳɰ���Ӧ��ƽ�ⳣ��Kֵ���¶ȵĹ�ϵ���£�
�� �ȣ��棩 | 360 | 440 | 520 |
Kֵ | 0.036 | 0.010 | 0.0038 |
��25��ʱ1Ħ��������ȫת��Ϊ�����ų�92.4KJ��������д����ҵ�ϳɰ����Ȼ�ѧ����ʽ____________��
��5���ϳɰ���ԭ����H2����ͨ����ӦCO(g) + H2O(g)![]() CO2 (g) + H2(g) ��ȡ��
CO2 (g) + H2(g) ��ȡ��
��T ��ʱ�����ݻ��̶�Ϊ5 L�������г���1 molˮ������1 mol CO����Ӧ��ƽ����CO��Ũ��Ϊ0.08 mol��L-1����ƽ��ʱCO��ת����Ϊ_______�����¶��·�Ӧ��ƽ�ⳣ��KֵΪ_________��
�ڱ����¶���ΪT �棬ֻ�ı�ˮ������CO�ij�ʼ���ʵ���֮�ȣ�������������з�Ӧ�����������ܹ�˵����ϵ����ƽ��״̬����_____________������ţ���
a��������ѹǿ����ʱ��ı�
b�����������ܶȲ���ʱ��ı�
c����λʱ��������a mol CO2��ͬʱ����a mol H2
d���������n(CO) : n(H2O) : n(CO2) : n(H2) �� 1: 16 : 6 : 6
���𰸡��� NH4++H2O![]() NH3��H2O+H+ D ����ʳ��ˮ �������� 2Cl- +2H2O
NH3��H2O+H+ D ����ʳ��ˮ �������� 2Cl- +2H2O ![]() Cl2��+H2��+2OH- N2(g)+3H2(g)=2NH3(g) ��H=-92.4KJ/mol 60% 9/4 cd
Cl2��+H2��+2OH- N2(g)+3H2(g)=2NH3(g) ��H=-92.4KJ/mol 60% 9/4 cd
��������
��1��NH4Cl����ǿ�������Σ�笠�����ˮ����Һ�����ԣ�
��2�����ݵ���ʡ��ǵ���ʵĸ�������жϣ����ʵ���������Ǻ��������ƶ������ӻ����ɵ������ݴ˽��з�����
��3����������������������������������ͼʾװ���еĽ���Ĥ�������ӽ���Ĥ��A������Ҫ�DZ���NaCl��Һ��B������Ҫ������������Һ��װ���ǵ�ⱥ��ʳ��ˮ�����������Ȼ��ƺ�ˮ��Ӧ�����������ƺ������������������Ϸ��������
��4������ͼ����Ϣ��֪���ϳɰ���ӦΪ���ȷ�Ӧ�����25��ʱ1Ħ��������ȫת��Ϊ�����ų�92.4KJ��������д���ϳɰ����Ȼ�ѧ����ʽ��
��5�������ݻ�ѧƽ������ʽ��ʽ����ƽ��Ũ�������ƽ�ⳣ���������õ���
�����ݻ�ѧƽ��״̬,��Ӧ�����淴Ӧ������ͬ,���ɷֺ������ֲ��������
��1��NH4Cl����ǿ����������笠�����ˮ����Һ��������pH��7�����ӷ���ʽΪ��NH4++H2O![]() NH3��H2O+H+��
NH3��H2O+H+��
��������������������� ��NH4++H2O![]() NH3��H2O+H+��
NH3��H2O+H+��
��2��A.���ǵ���,���ǵ����,��A������
B.�����ǻ����,���ǵ����,��B������
C.�Ȼ�����ˮ��Һ�������״̬���ܵ���Ļ�����,�ǵ����,���Dz����������ƶ������ӻ����ɵ���,������,��C������
D.�����������ƺ��������ƶ��������ܹ�����,�ǵ����,��D��ȷ��
��������������ѡD��
��3����������������������������������ͼʾװ���еĽ���Ĥ�������ӽ���Ĥ��A������Ҫ�DZ���NaCl��Һ��B������Ҫ������������Һ��װ���ǵ�ⱥ��ʳ��ˮ�����������Ȼ��ƺ�ˮ��Ӧ�����������ƺ���������������Ӧ�����ӷ���ʽΪ��2Cl- +2H2O ![]() Cl2��+H2��+2OH-��
Cl2��+H2��+2OH-��
��ˣ�������ȷ����������ʳ��ˮ������������2Cl- +2H2O ![]() Cl2��+H2��+2OH-��
Cl2��+H2��+2OH-��
��4������ͼ�������ݿ�֪���¶�������Kֵ��С���÷�Ӧ����ӦΪ���ȷ�Ӧ����25��ʱ1mol������ȫת��Ϊ�����ų�92.4KJ����������÷�Ӧ���Ȼ�ѧ����ʽΪN2(g)+3H2(g)=2NH3(g) ��H=-92.4KJ/mol��
�������������������N2(g)+3H2(g)=2NH3(g) ��H=-92.4KJ/mol��
��5�������ݻ�ѧƽ������ʽ��ʽ����ƽ��Ũ�ȣ�T ��ʱ�����ݻ��̶�Ϊ5L�������г���1molˮ������1molCO����Ӧ��ƽ����CO��Ũ��Ϊ0.08molL-1��
CO��g��+H2O��g���TCO2��g��+H2��g��
��ʼ����mol/L�� 0.2 0.2 0 0
�仯����mol/L�� 0.12 0.12 0.12 0.12
ƽ������mol/L�� 0.08 0.08 0.12 0.12
ƽ��ʱCO��ת����=0.12/0.2=��100%=60%������¶��·�Ӧ��ƽ�ⳣ��K=��0.12��0.12��/��0.08��0.08��=9/4��
��ˣ�������ȷ���ǣ�60%��9/4��
�ڻ�ѧƽ��״̬����Ӧ�����淴Ӧ������ͬ�����ɷֺ������ֲ������ѡ�CO��g��+H2O��g���TCO2��g��+H2��g������Ӧ������������䷴Ӧ��
a����Ӧ�����к�ƽ��״̬��ѹǿ��ͬ��������ѹǿ����ʱ��ı䣬����˵����Ӧ�ﵽƽ��״̬����a�����ϣ�
b��������������غ㣬��Ӧǰ������������䣬��Ӧ�����к�ƽ��״̬�£����������ܶȲ���ʱ��ı䣬����˵����Ӧ�ﵽƽ��״̬����b�����ϣ�
c����λʱ��������amolCO2��ͬʱ����amolH2��˵��������̼�����������淴Ӧ������ͬ��˵����Ӧ�ﵽƽ��״̬����c���ϣ�
d���������n��CO����n��H2O����n��CO2����n��H2��=1��16��6��6�����ݷ�Ӧǰ���������ʵ�����ͬ�������������ʵ�������Ũ�ȼ���Ũ���̺�ƽ�ⳣ���Ƚϣ�Q=6��6/1��16=2.25=K��˵����Ӧ�ﵽƽ��״̬����d���ϣ�
��ˣ�������ȷ���ǣ�cd��


 ��˼ά������ҵ��ټ��ִ�ѧ������ϵ�д�
��˼ά������ҵ��ټ��ִ�ѧ������ϵ�д� �����������Ż�ѧϰϵ�д�
�����������Ż�ѧϰϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����о�ԭ�Ӻ�������Ų���Ԫ�����ڱ��Ĺ�ϵʱ, ���Ƿ��ּ۵����Ų����Ƶ�Ԫ�ؼ�����һ�𡣾ݴ�,���ǽ�Ԫ�����ڱ���Ϊ�����,�������������ӵĹ���ܼ�������Ϊ�����ķ���,����ͼ��ʾ��

(1)��![]() ����,���������ԭ��������С��Ԫ��,ԭ�ӵļ۵��ӵĵ�������״Ϊ__________��
����,���������ԭ��������С��Ԫ��,ԭ�ӵļ۵��ӵĵ�������״Ϊ__________��
(2)��![]() ����,���������ԭ��������С��Ԫ��,�������ӵĵ����Ų�ʽΪ__________,���н��ȶ�����__________��
����,���������ԭ��������С��Ԫ��,�������ӵĵ����Ų�ʽΪ__________,���н��ȶ�����__________��
(3)�ڵ�4���ڵ�![]() ����,���������ԭ����������Ԫ��,ԭ�ӵļ۵����Ų�ʽΪ__________��
����,���������ԭ����������Ԫ��,ԭ�ӵļ۵����Ų�ʽΪ__________��
(4)��![]() ����,��2����VA��Ԫ��ԭ�Ӽ۵����Ų�ͼΪ__________��
����,��2����VA��Ԫ��ԭ�Ӽ۵����Ų�ͼΪ__________��
(5)�������ں��ܿ�����Ԫ�����˺���,������__________���С�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A��Ԫ��(C��Si��Ge��Sn��Pb)���仯�����ڲ��ϵȷ�������Ҫ��;���ش��������⣺
(1) Pb�ļ۲�����Ų�ͼΪ��____________��
(2)GeC14������ԭ�ӵļ۲���Ӷ���Ϊ____________�����ӵ����幹��Ϊ___________��GeC14��ˮ������һ���������һ�������ᣬ�仯ѧ��Ӧ����ʽΪ��________________________________��
(3)��±����![]() �ķе�Ͷ�±��Ǧ
�ķе�Ͷ�±��Ǧ![]() ���۵�����ͼ��ʾ��
���۵�����ͼ��ʾ��

��![]() �ķе���F��CI��Br��I�������ߵ�ԭ����____________��
�ķе���F��CI��Br��I�������ߵ�ԭ����____________��
�ڽ��![]() �ķе��
�ķе��![]() ���۵�ı仯���ɣ����ƶϣ���F��Cl��Br��I����
���۵�ı仯���ɣ����ƶϣ���F��Cl��Br��I����![]() �л�ѧ����������__________(������ǿ������������������������ͬ)��������__________��
�л�ѧ����������__________(������ǿ������������������������ͬ)��������__________��

(4)̼����һ�ֵ���![]() ��������γɵ��³�������������ṹ��ͼ��ʾ���˻�����ɿ�����K�����
��������γɵ��³�������������ṹ��ͼ��ʾ���˻�����ɿ�����K�����![]() �γɵ������������϶�Ͱ������϶֮�У����������϶��ĿΪ_________������һ�ּ����X(���ԭ������ΪM)��
�γɵ������������϶�Ͱ������϶֮�У����������϶��ĿΪ_________������һ�ּ����X(���ԭ������ΪM)��![]() ���γ����ƻ������Xֻ���
���γ����ƻ������Xֻ���![]() �γɵİ������϶��һ�룬�˻�����Ļ�ѧʽΪ��__________���侧������Ϊ1.4nm�������ܶ�Ϊ_________
�γɵİ������϶��һ�룬�˻�����Ļ�ѧʽΪ��__________���侧������Ϊ1.4nm�������ܶ�Ϊ_________![]() (�ú�M�Ͱ���٤��������ֵ
(�ú�M�Ͱ���٤��������ֵ![]() ��ʽ�ӱ�ʾ)
��ʽ�ӱ�ʾ)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£�ͨ�����з�Ӧ��ʵ��ȼú��������Ļ��գ�
SO2(g)+2CO(g)![]() 2CO2(g)+S(l)��H��0 ����Ӧ�ں��ݵ��ܱ������н��У������й�˵����ȷ����
2CO2(g)+S(l)��H��0 ����Ӧ�ں��ݵ��ܱ������н��У������й�˵����ȷ����
A. ƽ��ǰ�����ŷ�Ӧ�Ľ��У�������ѹǿʼ�ղ���
B. ƽ��ʱ�������������䣬�����������Ӧ���ʼӿ�
C. ƽ��ʱ�������������䣬�����¶ȿ����SO2��ת����
D. �����������䣬ʹ�ò�ͬ�������÷�Ӧƽ�ⳣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ���տα�ʵ��Ҫ����50 mL 0.50 mol/L��������50 mL 0.55 mol/L��NaOH ��Һ��ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų������������к��ȡ�����˵����ȷ����(����)

A. ʵ�������û��������ʧ
B. �ձ���������ֽ���������ǹ̶�С�ձ�
C. ͼ��ʵ��װ��ȱ�ٻ��β��������
D. �������������Ϊ60 mL�������������к��Ȳ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ���ǣ� ��
A. Ħ���ǹ��ʵ�λ�����߸�����������֮һ
B. ����Ħ������������ԭ�ӵ����ԭ������
C. ����NA����ԭ�ӵ���������ʵ�����0.25mol
D. 40gNaOH����1Lˮ�����ʵ����ʵ���Ũ��Ϊ1mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���α������һ������Ѫ�����ŵĽ�Ѫѹҩ�һ�ֺϳ��α�����м���G�IJ����������£�

��֪���������Ľṹ��ʽΪ![]() ��
��
��ش��������⣺
��1��A��������______��B�����������ŵ�������______��
��2����Ӧ�ݵĻ�ѧ����ʽΪ______���÷�Ӧ�ķ�Ӧ������______��
��3��G�ķ���ʽΪ______��
��4��д����������������E��ͬ���칹��Ľṹ��ʽ��______��______��
������ֻ������ȡ����
��˴Ź�������ͼ��ֻ��4�����շ�
��.1mol������������NaHCO3��Һ��Ӧ����2molCO2
��5����������֪ʶ����������Ϣ��д����![]() Ϊԭ���Ʊ�
Ϊԭ���Ʊ�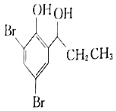 �ĺϳ�·������ͼ�����Լ���ѡ��______���ϳ�·������ͼʾ�����£�CH3CH2Br
�ĺϳ�·������ͼ�����Լ���ѡ��______���ϳ�·������ͼʾ�����£�CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH3COOCH2CH3
CH3COOCH2CH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�ҷ��ֶ�ұ�����е�⾫���ᴿ�ɽ��ߴ����Ʊ��ɱ�����ص���װ������ͼ����Cu��Si�Ͻ�����Դ����950����������Һ���ν��е�⾫����������ijCH4ȼ�ϵ�أ���ͼ����Ϊ��Դ���й�˵������ȷ����

A. �缫c��a������d��b����
B. �������У�Si ������Cu����ԭ��Cu������Si������
C. ����Һ���ε������������ⷴӦ�������߹����Ч��
D. ��ͬʱ���£�ͨ��CH4��O2�������ͬ����Ӱ����ᴿ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NAΪ�����ӵ�������ֵ������˵����ȷ����
A. 1molH2��1molI2�ڼ��������³�ַ�Ӧ������HI�ķ�����Ϊ2NA
B. 10g��������Ϊ46%���Ҵ���Һ���е���ԭ����ĿΪ0.6NA
C. 20mL0.1 mol/LAlCl3��Һ�У�ˮ���γ�Al(OH)3����������Ϊ0.002NA
D. 0.1molNa2O2��Na2O�Ļ�����к��е�������������0.3NA
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com