
【题目】对于反应C(s)+H2O(g)CO(g)+H2(g);△H>0,下列有关说法正确的是( )
A.升高体系温度,平衡常数K减小
B.增大体系压强,平衡常数K不发生变化
C.平衡常数表达式为K= ![]()
D.增加C(s)的量,平衡正向移动
【答案】B
【解析】解:A.正反应为吸热反应,升高体系温度,平衡正向移动,K增大,故A错误;
B.化学平衡常数只受温度的影响,与体系的压强无关,故B正确;
C.C为固体,不带入K的表达式中,因此K= ![]() ,故C错误;
,故C错误;
D.固体物质的浓度视为定值,因此增加C(s)的量,平衡不移动,故D错误;
故选B.
【考点精析】关于本题考查的化学平衡状态本质及特征,需要了解化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)才能得出正确答案.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( ) 
A.混合酸中H2SO4浓度为4 molL﹣1
B.200mL混合酸中NO3﹣物质的量为0.2mol
C.AB段的反应为Fe+2Fe3+═3Fe2+ , BC段产生氢气
D.加入铜粉的那份混合酸,反应后剩余0.1mol H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温钠硫电池是一种新型可充电电池,其工作原理如图所示,图中固体电解质是Na+导体.下列叙述正确的是( ) 
A.放电时,石墨电极a为正极
B.放电时,Na+从石墨b向石墨a方向迁移
C.充电时,b极反应为Na2Sx﹣2e﹣=xS+2Na+
D.可将装置中的固体电解质改成NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境监测测定水中溶解氧的方法是:
①量取amL水样,迅速加入固定剂MnSO4溶液和碱性KI溶液(含KOH),立即塞好瓶塞,反复振荡,使之充分反应,其反应式为:2Mn2++O2+4OH﹣=2MnO(OH)2(该反应极快).
②测定:打开瓶塞后迅速加入1~2mL浓硫酸(酸化),使之生成I2 , 再用b mol/L的Na2S2O3溶液滴定(以淀粉为指示剂),消耗V mL.有关反应式为MnO(OH)2+2I﹣+4H+=Mn2++I2+3H2O I2+4S2O32﹣=2I﹣+S2O32﹣
试回答:
(1)滴定过程中用到的玻璃仪器除了酸式滴定管、碱式滴定管外还缺少 ,
(2)滴定操作时,左手控制滴定管,右手 , 眼睛要注视
(3)滴定时(I﹣和S2O32﹣反应)以淀粉为指示剂,终点时溶液由色变为色.
(4)水中溶解氧的计算式为 . (以g/L为单位)
(5)测定时,滴定管经蒸馏水洗涤后立即加入滴定剂Na2S2O3标准溶液进行滴定,则会导致测定结果(填“偏高”“偏低”或“无影响”,下同).
(6)记录测定结果时,滴定前仰视刻度线,滴定到达终点时又俯视刻度线,将导致滴定结果 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表的形式多种多样,如图是扇形元素周期表的一部分,对比中学常见元素周期表,分析其元素的填充规律,判断下列说法正确的是( ) 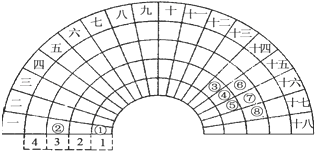
A.③元素形成的单质晶体均属于原子晶体
B.④元素的气态氢化物易液化,是因为其分子间存在氢键
C.②、⑦、⑧对应的简单离子半径依次减小
D.②⑤⑦三种元素形成的盐溶液在25℃时的pH值为7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不可以用氢键来解释的是()
A.水是一种非常稳定的化合物
B.测量氟化氢分子量的实验中,发现实验值总是大于20
C.水结成冰后,体积膨胀,密度变小
D.氨气容易液化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由短周期元素组成的中学常见的含钠元素的物质A、B、C、D,存在如图1转化关系(部分生成物和反应条件已略去). 
(1)若A为金属钠,A与水反应的离子方程式为 .
(2)若A为过氧化钠,A与水反应的化学方程式为 .
(3)A不论是Na还是Na2O2 , 依据转化关系判断物质D是 ,
(4)向30ml某浓度的B溶液中通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同.若向M中逐滴加入0.1mol/L盐酸,产生的气体V(CO2)与加入盐酸的体积V(HCl)的关系有如图2所示两种情况(不计CO2的溶解),则曲线B表明M中的溶质为;原NaOH溶液的物质的量浓度为;由曲线A、B可知,两次实验通入的CO2的体积比为 .
(5)Na2CO3和NaHCO3浓度均为0.1mol/L的混合溶液中,离子浓度由小到大的顺序是请你设计一实验证明Na2CO3溶液碱性比NaHCO3溶液的碱性强: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com