
雄黄(AS4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生.根据题意完成下列填空:
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体.若As2S3和SnCl2正好完全反应,该反应的化学方程式为________.
(2)上述反应中的氧化剂是________,反应产生的气体可用________吸收.
(3)As2S3和HNO3有如下反应:As2S3+10H++10NO![]() =2H3AsO4+3S+10NO2↑+2H2O,若生成2 mol H3AsO4,则反应中转移电子的物质的量为________.若将该反应设计成一原电池,则NO2应该在________极附近逸出.
=2H3AsO4+3S+10NO2↑+2H2O,若生成2 mol H3AsO4,则反应中转移电子的物质的量为________.若将该反应设计成一原电池,则NO2应该在________极附近逸出.
(4)将(3)中反应产物NO2充满干燥的烧瓶,然后将烧瓶倒立于少水槽中,向烧瓶中通入一定量的氧气,气体恰好完全溶于水(假设溶液没有扩散),则烧瓶中溶液溶质的物质的量浓度为________(设该条件下的气体摩尔体积为23.8 L·mol-1,结果保留到小数点后三位).
 星级口算天天练系列答案
星级口算天天练系列答案科目:高中化学 来源: 题型:
(14分)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1) As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,则氧化剂与氧化产物的物质的量之比为 ▲ 。
(2)上述反应中产生的气体可用 ▲ 吸收。
(3) As2S3和HNO3有如下反应:As2S3+ 10H++ 10NO3—= 2H3AsO4+ 3S+10NO2↑+2H2O
若生成48g S,则生成标准状况下的NO2的体积为 ▲ L。若准确测得的实际体积小于理论值(计算值),请分析可能原因 ▲ 。
(4)某课外活动小组设计了以下实验方案验证Ag与浓HNO3反应的过程中可能产生NO。其实验流程图如下:
①测定硝酸的物质的量:
反应结束后,从如图B装置中所得100 mL溶液中取出25.00 mL溶液,用0.1 mol·L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置如上图所示。在B容器中生成硝酸的物质的量为 ▲ 。
②测定NO的体积:
若实验测得NO的体积为112.0mL(已折算到标准状况),则Ag与浓硝酸反应的过程中
▲ (填“有”或“没有”)NO产生,作此判断的依据是 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1) As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为 ( 。)
(2)上述反应中的氧化剂是( ),反应产生的气体可用( )吸收。
(3) As2S3和HNO3有如下反应:As2S3+ 10H++ 10NO3—=2H3AsO4+ 3S+10NO2↑+ 2H2O
若生成2molH3AsO4,则反应中转移电子的物质的量为( )。若将该反应设计成一原电池,则NO2应该在( )(填“正极”或“负极”)附近逸出。
(4)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量 ( )(选填编号)。
a.小于0.5 mol b.等于0.5 mol c.大于0.5mol d.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
(共12分)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2按1:1正好完全反应,则反应方程式为 。
(2)上述反应中的还原剂是 ,为了防止大气污染,反应产生的气体可用 吸收。
(3)As2S3和HNO3有如下反应:As2S3+10H++ 10 NO-3 = 2H3AsO4+3S↓+10NO2↑+ 2H2O
若生成1mol NO2 ,则反应中转移的电子数为 。若将该反应设计成一原电池,则NO2应该在 (填“正极”或“负极”)附近逸出。
(4)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量 (选填编号)。
a.等于0.5mol b.小于0.5 mol c.大于0.5mol d.无法确定
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江苏省南通市高三第一次调研测试化学试卷(解析版) 题型:实验题
硫在地壳中主要以硫化物、硫酸盐等形式存在,其单质和化合物在工农业生产中有着重要的应用。
(1)已知:重晶石(BaSO4)高温煅烧可发生一系列反应,其中部分反应如下:
BaSO4(s)+4C(s)=BaS(s)+4CO(g)? △H= + 571.2 kJ?mol—1
BaS(s)= Ba(s)+S(s)? △H= +460 kJ?mol—1
已知:2C(s)+O2(g)=2CO(g)? △H= -221 kJ?mol—1
则:Ba(s)+S(s)+2O2(g)=BaSO4(s)? △H= ? ? 。
(2)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料。已知As2S3和HNO3有如下反应:
As2S3+10H++ 10NO3-=2H3AsO4+3S+10NO2↑+ 2H2O
当反应中转移电子的数目为2mol时,生成H3AsO4的物质的量为?? 。
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中主要含硫各物种(H2S、HS—、S2—)的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如下图所示(忽略滴加过程H2S气体的逸出)。
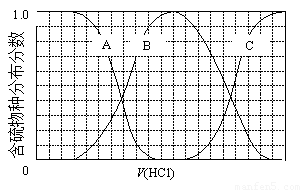
①含硫物种B表示???? 。在滴加盐酸过程中,溶液中c(Na+)与含硫各物种浓度的大小关系为 ? (填字母)。
a.c(Na+)= c(H2S)+c(HS—)+2c(S2—)
b.2c(Na+)=c(H2S)+c(HS—)+c(S2—)
c.c(Na+)=3[c(H2S)+c(HS—)+c(S2—)]
②NaHS溶液呈碱性,若向溶液中加入CuSO4溶液,恰好完全反应,所得溶液呈强酸性,其原因是 ? (用离子方程式表示)。
(4)硫的有机物(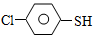 )与甲醛、氯化氢以物质的量之比1:1:1反应,可获得一种杀虫剂中间体X和H2O。
)与甲醛、氯化氢以物质的量之比1:1:1反应,可获得一种杀虫剂中间体X和H2O。
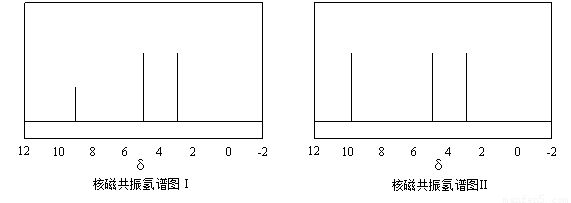
 及X的核磁共振氢谱如下图,其中???? (填“Ⅰ”或“Ⅱ”)为
及X的核磁共振氢谱如下图,其中???? (填“Ⅰ”或“Ⅱ”)为 的核磁共振氢谱图。写出X的结构简式:???? 。
的核磁共振氢谱图。写出X的结构简式:???? 。
查看答案和解析>>
科目:高中化学 来源:2014届山西大学附属中学高二暑假8月考试化学试卷(解析版) 题型:填空题
(6分)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1) As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为 。
(2)上述反应中的还原剂是 ,反应产生的气体可用 吸收。
(3) As2S3和HNO3有如下反应:As2S3+ 10H++ 10NO3—=2H3AsO4+ 3S+10NO2↑+ 2H2O
若生成2mol H3AsO4,则反应中转移电子的物质的量为 。若将该反应设计成一原电池,则NO2应该在 (填“正极”或“负极”)附近逸出。
(4)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量 (选填编号)。
a.小于0.5 mol b.等于0.5 mol c.大于0.5mol d.无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com