
【题目】为了提高汽油产量,在石油提炼过程中常采用的化学方法是( )
A.常压分馏
B.催化裂化
C.减压分馏
D.高压分馏
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:
【题目】对于A2+3B2═2C+D(均为气态物质)的反应来说,以下化学反应速的表示中,反应速率最快的是( )
A.v(A2)=0.4 molL﹣1s﹣1
B.v(D)=6 molL﹣1min﹣1
C.v(C)=0.6 molL﹣1s﹣1
D.v(B2)=0.8 molL﹣1s﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为解决能源短缺问题,工业生产中应合理利用化学能。
(1)25℃,1.01×105Pa时,实验测得,4g氢气在O2中完全燃烧生成液态水,放出572KJ的热量,则表示H2的燃烧热的热化学方程式为_________
(2)如图是某笔记本电脑使用的甲醇燃料电池的结构示意图放电时甲醇应从____处通入(填“a”或“b”).电池内部H+向______(填“左”或“右”)移动。写出电池负极的电极反应式_____。
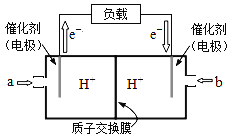
(3)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.已知:N2(g)+3H2(g)=2NH3(g)ΔH=-93kJ/mol,试根据表中所列键能数据计算a的数值__________。
化学键 | H-H | N-H | N≡N |
键能/kJmol | 436 | a | 945 |
当可逆反应中净生成N-H物质的量为2mol时,反应放热________
(4) 已知:C(s,石墨)+O2(g)=CO2(g)△H1=-393.5kJmol-1
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJmol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3=-2599kJmol-1
根据盖斯定律,计算反应2C(s,石墨)+H2(g)=C2H2(g)的△H=___.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对 ![]() X与
X与 ![]() X+两种微粒,下列叙述正确的是( )
X+两种微粒,下列叙述正确的是( )
A.一定都是由质子、中子、电子组成的
B.质子数一定相同,质量数和中子数一定不相同
C.核电荷数和核外电子数一定相等
D.化学性质几乎完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在容积为1 L的密闭容器中发生可逆反应:Fe(s)+H2O(g) ![]() FeO(s)+H2(g) ΔH>0。在1 000℃时,H2O(g)的平衡转化率(α)与体系总压强(p)关系如图所示。
FeO(s)+H2(g) ΔH>0。在1 000℃时,H2O(g)的平衡转化率(α)与体系总压强(p)关系如图所示。
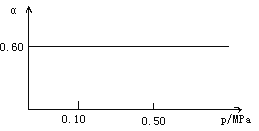
(1)写出该反应的平衡常数表达式K=__________。当反应达到平衡后,再向容器中加入铁粉和水蒸气,则K__________,(填“增大”、“减小”或“不变”,下同);升高温度,则K__________。
(2)在1 000℃时,若向上述容器中加入0.80 mol铁粉和1.00 mol水蒸气,达到平衡时,容器中c(H2)=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.1mol·L-1 KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
(A)移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
(E)调节液面至0或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写) 。
(2)上述(B)操作的目的是 。
(3)上述(A)操作之前,如先用待测液润洗锥形瓶,则对测定结果的影响是(填偏大、偏小、不变,下同) 。
(4)实验中用左手控制 (填仪器及部位),眼睛注视 ,直至滴定终点。判断到达终点的现象是 。
(5)若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,则对测定结果的影响是 。
(6)滴定结束后如仰视观察滴定管中液面刻度,则对滴定结果的影响是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将14g铜银合金与足量的HNO3反应,将产生的气体与1.12L O2(标准状况下)混合后,通入水中,恰好被全部吸收,则合金中Ag的质量为( )
A.3.2 g
B.4.8 g
C.6.4 g
D.10.8 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com