
【题目】一定条件下,在容积为1 L的密闭容器中发生可逆反应:Fe(s)+H2O(g) ![]() FeO(s)+H2(g) ΔH>0。在1 000℃时,H2O(g)的平衡转化率(α)与体系总压强(p)关系如图所示。
FeO(s)+H2(g) ΔH>0。在1 000℃时,H2O(g)的平衡转化率(α)与体系总压强(p)关系如图所示。
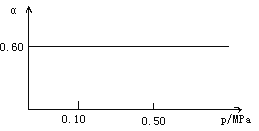
(1)写出该反应的平衡常数表达式K=__________。当反应达到平衡后,再向容器中加入铁粉和水蒸气,则K__________,(填“增大”、“减小”或“不变”,下同);升高温度,则K__________。
(2)在1 000℃时,若向上述容器中加入0.80 mol铁粉和1.00 mol水蒸气,达到平衡时,容器中c(H2)=______。
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 反应A(g) ![]() 2B(g) ΔH,若正反应的活化能为EakJ/mo1,逆反应的活化能为EbkJ/mol,则ΔH=-(Ea-Eb)kJ/mol
2B(g) ΔH,若正反应的活化能为EakJ/mo1,逆反应的活化能为EbkJ/mol,则ΔH=-(Ea-Eb)kJ/mol
B. 将浓度为0.1mol/LHF溶液加水不断稀释过程中,电离平衡常数Ka(HF)保持不变,c(F-)/c(H+)始终保持增大
C. 100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性
D. 0.1mol/L的醋酸的pH=a,0.0lmol/L的醋酸的pH=b,则a+1>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数值.下列有关叙述正确的是( )
A.1 mol D2O分子所含的中子数为8NA
B.48 g氧气和臭氧的混合气体中的氧原子数为3NA
C.11.2 L 甲烷(CH4)中的共价键数为2NA
D.1 mol N2与3 mol H2反应生成的NH3分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤矿的矿井里为了防止“瓦斯”(甲烷)爆炸事故,应采取的安全措施是( )
A.通风并严禁烟火
B.进矿井前先用明火检查是否有甲烷
C.戴防毒面具
D.用大量水吸收甲烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列各题。
(1)FeCl3溶液中加入KSCN呈红色,写出离子方程式_________________________。
(2)NaHCO3溶液显碱性的原因_________________________。
(3)NH4Cl溶液加入锌粒产生气体的离子方程式_________________________。
(4)已知16克固体硫充分燃烧放出148.4kJ的热量,则该反应的热化学方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知250C时,醋酸溶液中电离平衡常数为k= ×10-5,回答下列问题:
×10-5,回答下列问题:
(1)向溶液中加入少量盐酸,电离平衡______移动,K值________(填“增大” “不变”“减小”)。
(2)若醋酸的起始浓度为0.010mol/L,则平衡时c(H+)=____________________(提示:平衡时的醋酸浓度可近似看为0.010mol/L)。
(3)(2)问中的醋酸电离度为_____________(电离度即醋酸的电离平衡转化率)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】10mLNO、CO2的混合气体通过足量的Na2O2后,气体的体积变为6mL(相同状况),则NO和CO2的体积比为( )
A.1:1
B.2:1
C.3:2
D.1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个制取氯气并以氯气为原料进行特定反应的装置,请回答下列问题. 
(1)A是氯气发生装置,其中发生反应的离子方程式为 .
(2)实验开始时,先点燃装置A处的酒精灯,打开弹簧夹K,让Cl2充满整个装置,再点装置D处的酒精灯,Cl2通过C瓶后再进入D(D装置的硬质玻璃管内盛有碳粉)发生氧化还原反应,其产物为CO2和HCl.D中发生反应的化学方程式为 , 装置C的作用是 .
(3)实验过程中,E处产生的现象为 .
(4)D处反应完毕后,关闭弹簧夹K,移去酒精灯,由于余热的作用,A处仍有Cl2产生,此时B中出现的现象是 , 装置B的作用是 .
(5)若实验中使12molL﹣1的浓盐酸10mL与足量的MnO2反应,则生成的Cl2的物质的量总是小于0.03mol,其原因是 .
(6)若要吸收从硬质玻璃管中导出的气体,E中应盛放溶液,其中有毒气体与之反应的离子方程式是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com