
【题目】如图是一个制取氯气并以氯气为原料进行特定反应的装置,请回答下列问题. 
(1)A是氯气发生装置,其中发生反应的离子方程式为 .
(2)实验开始时,先点燃装置A处的酒精灯,打开弹簧夹K,让Cl2充满整个装置,再点装置D处的酒精灯,Cl2通过C瓶后再进入D(D装置的硬质玻璃管内盛有碳粉)发生氧化还原反应,其产物为CO2和HCl.D中发生反应的化学方程式为 , 装置C的作用是 .
(3)实验过程中,E处产生的现象为 .
(4)D处反应完毕后,关闭弹簧夹K,移去酒精灯,由于余热的作用,A处仍有Cl2产生,此时B中出现的现象是 , 装置B的作用是 .
(5)若实验中使12molL﹣1的浓盐酸10mL与足量的MnO2反应,则生成的Cl2的物质的量总是小于0.03mol,其原因是 .
(6)若要吸收从硬质玻璃管中导出的气体,E中应盛放溶液,其中有毒气体与之反应的离子方程式是 .
【答案】
(1)MnO2+4H++2Cl﹣ ![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
(2)2Cl2+2H2O(气)+C ![]() 4HCl+CO2;吸收氯气中的HCl,提供D处反应所需的水蒸气
4HCl+CO2;吸收氯气中的HCl,提供D处反应所需的水蒸气
(3)E中溶液先变红后褪色
(4)B中液面下降,长颈漏斗内液面升高,B中液面上方有黄绿色气体;贮存少量多余的Cl2
(5)随着反应的进行,盐酸的浓度不断减小,减小到一定程度时将不再进行反应
(6)强碱;Cl2+2OH﹣=Cl﹣+ClO﹣+H2O
【解析】解:(1)实验室利用二氧化锰与浓盐酸在加热条件下制备氯气,反应生成氯化锰、氯气与水,反应的离子方程式为:MnO2+4H++2Cl﹣ ![]() Mn2++Cl2↑+2H2O;所以答案是:MnO2+4H++2Cl﹣
Mn2++Cl2↑+2H2O;所以答案是:MnO2+4H++2Cl﹣ ![]() Mn2++Cl2↑+2H2O;(2)氯气有强氧化性,碳有还原性,在加热条件下氯气和水、碳发生氧化还原反应生成氯化氢和二氧化碳,反应方程式为:2Cl2+2H2O(气)+C
Mn2++Cl2↑+2H2O;(2)氯气有强氧化性,碳有还原性,在加热条件下氯气和水、碳发生氧化还原反应生成氯化氢和二氧化碳,反应方程式为:2Cl2+2H2O(气)+C ![]() 4HCl+CO2;2Cl2+C+2H2O═CO2+4HCl;盐酸有挥发性,所以制取的氯气中含有氯化氢气体,氯化氢极易溶于水,通过以上分析知,C装置的作用是:吸收Cl2中的HCl气体,提供D处所需水蒸气,所以答案是:2Cl2+2H2O(气)+C
4HCl+CO2;2Cl2+C+2H2O═CO2+4HCl;盐酸有挥发性,所以制取的氯气中含有氯化氢气体,氯化氢极易溶于水,通过以上分析知,C装置的作用是:吸收Cl2中的HCl气体,提供D处所需水蒸气,所以答案是:2Cl2+2H2O(气)+C ![]() 4HCl+CO2;吸收氯气中的HCl,提供D处反应所需的水蒸气;(3)剩余的氯气在E装置中和水反应生成盐酸和次氯酸,所以溶液呈酸性,紫色石蕊试液遇酸变红色,次氯酸有漂白性,能使溶液褪色, 所以答案是:E中溶液先变红后褪色;(4)因为A处仍有少量Cl2产生,氯气通过导管进入B装置,所以在B液面上方有黄绿色气体,导致B装置中压强增大;压强增大导致B装置中的液体进入长颈漏斗中;所以B处的作用是可以使内压降低,充当储气瓶,所以答案是:B中液面下降,长颈漏斗内液面升高,B中液面上方有黄绿色气体; 贮存少量多余的Cl2;(5)二氧化锰只与浓盐酸反应,12molL﹣1的浓盐酸10mL与足量的MnO2反应,随着反应的进行,盐酸的浓度不断减小,减小到一定程度时将不再进行反应,所以生成的Cl2的物质的量总是小于0.03mol;
4HCl+CO2;吸收氯气中的HCl,提供D处反应所需的水蒸气;(3)剩余的氯气在E装置中和水反应生成盐酸和次氯酸,所以溶液呈酸性,紫色石蕊试液遇酸变红色,次氯酸有漂白性,能使溶液褪色, 所以答案是:E中溶液先变红后褪色;(4)因为A处仍有少量Cl2产生,氯气通过导管进入B装置,所以在B液面上方有黄绿色气体,导致B装置中压强增大;压强增大导致B装置中的液体进入长颈漏斗中;所以B处的作用是可以使内压降低,充当储气瓶,所以答案是:B中液面下降,长颈漏斗内液面升高,B中液面上方有黄绿色气体; 贮存少量多余的Cl2;(5)二氧化锰只与浓盐酸反应,12molL﹣1的浓盐酸10mL与足量的MnO2反应,随着反应的进行,盐酸的浓度不断减小,减小到一定程度时将不再进行反应,所以生成的Cl2的物质的量总是小于0.03mol;
所以答案是:随着反应的进行,盐酸的浓度不断减小,减小到一定程度时将不再进行反应;(6)氯气能够与强碱反应,被强碱吸收,若要吸收从硬质玻璃管中导出的气体,E中应盛放强碱溶液,可以用氢氧化钠溶液吸收过量的氯气,二者反应生成氯化钠、次氯酸钠和水,反应的离子方程式:Cl2+2OH﹣=Cl﹣+ClO﹣+H2O;
所以答案是:强碱; Cl2+2OH﹣=Cl﹣+ClO﹣+H2O.
【考点精析】解答此题的关键在于理解氯气的实验室制法的相关知识,掌握实验室制法:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O.


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,在容积为1 L的密闭容器中发生可逆反应:Fe(s)+H2O(g) ![]() FeO(s)+H2(g) ΔH>0。在1 000℃时,H2O(g)的平衡转化率(α)与体系总压强(p)关系如图所示。
FeO(s)+H2(g) ΔH>0。在1 000℃时,H2O(g)的平衡转化率(α)与体系总压强(p)关系如图所示。
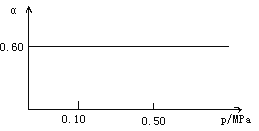
(1)写出该反应的平衡常数表达式K=__________。当反应达到平衡后,再向容器中加入铁粉和水蒸气,则K__________,(填“增大”、“减小”或“不变”,下同);升高温度,则K__________。
(2)在1 000℃时,若向上述容器中加入0.80 mol铁粉和1.00 mol水蒸气,达到平衡时,容器中c(H2)=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对石油工业叙述错误的是( )。
A.石油含有C5~C11的烷烃,可以通过石油的常压分馏得到汽油
B.催化裂化既能提高汽油产量又能提高汽油质量
C.石油裂解的目的是提高汽油产量
D.石油的减压分馏的生产目的是获得轻质油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将14g铜银合金与足量的HNO3反应,将产生的气体与1.12L O2(标准状况下)混合后,通入水中,恰好被全部吸收,则合金中Ag的质量为( )
A.3.2 g
B.4.8 g
C.6.4 g
D.10.8 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关科学家及其创建理论的描述中,错误的是
A.拉瓦锡阐明了质量守恒定律B.道尔顿创立分子学说
C.门捷列夫发现了元素周期律D.勒沙特列发现化学平衡移动原理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质有以下性质:①是电解质 ②溶解时有化学键的破坏 ③熔化时没有化学键的破坏,则该物质固态时属于
A. 原子晶体 B. 离子晶体 C. 分子晶体 D. 金属晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去括号内杂质的有关操作方法正确的是
物质(杂质) | 操作方法 | |
A | 苯(硝基苯) | 加少量蒸馏水,分液 |
B | 乙醇(水) | 加新制的生石灰,蒸馏 |
C | CO2(HCl) | NaOH溶液,洗气 |
D | 乙烷(乙烯) | 酸性KMnO4溶液,洗气 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类是化学研究中常用的方法。下列分类方法正确的是
A. 根据溶液酸碱性,将化合物分为酸、碱、盐
B. 根据分散质微粒直径大小,将分散系分为胶体、浊液和溶液
C. 根据水溶液是否导电,将化合物分为电解质和非电解质
D. 根据化合物是否来自于有机体,将化合物分为有机物和无机物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属及其化合物的说法正确的是 ( )
A. Na2O为淡黄色固体,MgO为白色固体
B. 金属钠具有强还原性,可用与TiCl4溶液反应制取金属Ti
C. 铁放入浓硝酸中无明显现象,说明铁与浓硝酸不反应
D. 工业上常用电解熔融氯化镁的方法制取金属镁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com