
【题目】25℃时,向10mL0.10mol·L-1一元弱酸HA(Ka=10-3)中逐滴加入0.10mol·L-1的NaOH溶液,溶液pH随所加NaOH溶液体积变化如图。下列说法不正确的是( )
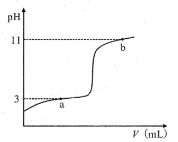
A.a点处存在c(HA)+c(OH-)=c(Na+)+c(H+)
B.b点处存在c(Na+)=c(HA)+c(OH-)+c(A-)
C.由a→b,溶液中n(A-)持续增大
D.V=10mL时,存在c(Na+)>c(A-)>c(OH-)>c(H+)
【答案】B
【解析】
A.根据图像,a点处溶质为NaA和HA,存在电荷守恒c(A-)+c(OH-)=c(Na+)+c(H+),由于a点pH=3,则c(H+)=10-3mol/L,又 ,又Ka=10-3,因此c(HA)=c(A-),则c(HA)+c(OH-)=c(Na+)+c(H+),A选项正确;
,又Ka=10-3,因此c(HA)=c(A-),则c(HA)+c(OH-)=c(Na+)+c(H+),A选项正确;
B.b点存在电荷守恒,c(A-)+c(OH-)=c(Na+)+c(H+),可得c(A-)+c(OH-)-c(H+)=c(Na+),若B选项成立,则c(A-)+c(OH-)-c(H+)=c(HA)+c(A-)+c(OH-),推出c(HA)+c(H+)=0,B选项错误;
C.由图像可知,a→b的过程跨越了pH突变区域,即跨越了滴定终点,滴定终点的溶质为NaA,从a点到滴定终点,HA的电离被促进,n(A-)持续增大,从滴定终点到b点,OH-抑制A-的水解,n(A-)也持续增大,C选项正确;
D.V=10mL时,溶质为NaA,由于A-+H2O![]() HA+OH-,溶液为碱性,因此c(Na+)>c(A-)>c(OH-)>c(H+),D选项正确;
HA+OH-,溶液为碱性,因此c(Na+)>c(A-)>c(OH-)>c(H+),D选项正确;
答案选B。


科目:高中化学 来源: 题型:
【题目】化合物G是一种重要的有机合成原料,其球棍模型如图甲所示。该化合物可用芳香烃A为原料来合成,其合成路线如图乙所示:
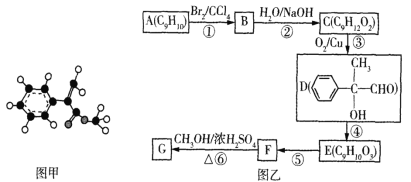
(1)下列关于G的说法不正确的是___(填标号)。
a.G的结构简式为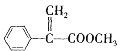
b.G能使酸性高锰酸钾溶液和溴水褪色,褪色原理相同
c.G的分子中所有碳原子可能处于同一平面内
d.G在一定条件下能发生水解、加成、加聚、氧化等反应
(2)F中的官能团名称为___,E的结构简式为___。
(3)反应①~⑥中属于取代反应的有___(填标号)。
(4)D的核磁共振氢谱的峰面积之比为____。
(5)写出D与银氨溶液反应的化学方程式:____。
(6)写出同时符合下列条件的F的同分异构体的结构简式:___(不考虑立体异构)。
a.分子内含苯环
b.苯环上只有一个支链
c.能发生银镜反应和水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,向2 L恒容密闭容器中加入2 mol X、1 mol Y。发生如下反应:2X(g)+Y(?)![]() 3Z(g) ΔH=-a kJ·mol-1(a>0)。经60 s达平衡,此时Y的物质的量为0.2 mol。下列说法错误的是( )
3Z(g) ΔH=-a kJ·mol-1(a>0)。经60 s达平衡,此时Y的物质的量为0.2 mol。下列说法错误的是( )
A.0~60 s内,用Z表示的化学反应速率为1.2 mol·L-1·min-1
B.若再充入1 mol Z,重新达到平衡时,X的体积分数不变,则Y为气态
C.达平衡后,实际放出的热量为b kJ,则b=a
D.若Y为气态,则使容器体积变为1 L,Z的物质的量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各溶液中,指定的离子组一定能大量共存的是( )
A.无色溶液中:K+、Cu2+、Cl-、SO![]()
B.含有0.1mol·L-1Fe3+的溶液中:K+、Mg2+、I-、NO![]()
C.在pH=1的溶液中:K+、Ba2+、Cl-、NO![]()
D.室温下,![]() =10-13的溶液中:Na+、Fe3+、NO
=10-13的溶液中:Na+、Fe3+、NO![]() 、SO
、SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向一个容积可变的容器中,通入3 mol SO2和2 mol O2及固体催化剂,使之发生反应:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=—196.6 kJ·mol-1,一段时间后达到平衡,平衡时容器内气体总的物质的量为起始时的90%.下列说法正确的是 ( )
2SO3(g) ΔH=—196.6 kJ·mol-1,一段时间后达到平衡,平衡时容器内气体总的物质的量为起始时的90%.下列说法正确的是 ( )
A.达到平衡时SO2的转化率约为33.3%
B.达到平衡时反应放出的热量为294.9 kJ
C.平衡时SO3的物质的量为2mol
D.达平衡时用O2表示的反应速率为0.25 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行如下反应:2SO2(g) +O2(g) ![]() 2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1 mol/L、0.2 mol/L,当反应达平衡时,可能存在的数据是
2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1 mol/L、0.2 mol/L,当反应达平衡时,可能存在的数据是
A. SO2为0.4mol/L
B. SO2为 0.25mol/L
C. SO2、SO3均为0.15mol/L
D. SO3为0.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于4NH3(g) + 3O2(g) = 2N2(g) + 6 H2O(g) 的反应来说,以下化学反应速率的表示中反应速率最快的是
A. v(NH3)=0.6 mol L-1min-1B. v(O2) =0.4 mol L-1min-1
C. v(N2)=0.2 mol L-1min-1D. v(H2O) =0.3 mol L-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组对H2O2的分解做了如下探究.下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同的粉末状和块状的MnO2分别加入盛有15ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
MnO2 触摸试管情况 观察结果 反应完成所需的时间
粉末状 很烫 剧烈反应,带火星的木条复燃 3.5min
块状 微热 反应较慢,火星红亮但木条未复燃 30min
(1)写出上述实验中发生反应的化学方程式: .
(2)实验结果表明,催化剂的催化效果与 有关.
(3)某同学在10mL H2O2 溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如图所示,则A、B、C三点所表示的反应速率最慢的是 .
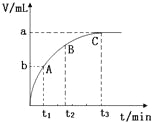
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含铬化合物及铬合金用途非常广泛。回答下列问题:
⑴基态Cr原子价电子排布式为___;第三电离能I3(Cr)=2987kJ·mol-1,I3(Mn)=3248kJ·mol-1,I3(Cr)<I3(Mn),其原因是___。
⑵Cr-Ni-Si是具有八边形相的准晶体,准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过___法区分晶体、准晶体和非晶体。
⑶已知反应:6KSCN+13K2Cr2O7+55H2SO4=13Cr2(SO4)3+6SO2↑+6CO2↑+6NO2↑+16K2SO4+55H2O。
①根据价层电子对互斥理论,SO2、CO2、H2O的气态分子中,中心原子价层电子对数目依次为___、___、___。
②写出一种与SCN-互为等电子体的分子:___(填化学式)。
③KSCN可制备配合物[Cr(NH3)6][Cr(SCN)6],该配合物中铬元素的化合价为___,两个配体NH3、SCN-中,中心原子杂化类型依次为___、___。
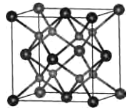
⑷一种具有萤石结构的CrO2的晶胞结构如图所示,晶胞参数为apm。则两个氧原子间的距离为___pm,Cr-O键的键长为___pm;设NA为阿伏加德罗常数的值,则CrO2的密度为___g·cm-3(列出计算式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com