
(16分)盐酸、醋酸和碳酸是化学实验和研究中常用的几种酸。
已知室温下:Ka(CH3COOH)=1.7×10-5 mol·L-1 ;H2CO3的电离常数Ka1=4.2×10-7mol·L-1 、 Ka2=5.6×10-11mol·L-1
(1)①请用离子方程式解释碳酸氢钠水溶液显碱性的原因 。
②常温下,物质的量浓度相同的下列四种溶液:
a、碳酸钠溶液 b、醋酸钠溶液 c、氢氧化钠溶液 d、氢氧化钡溶液。
其PH由大到小的顺序是: (填序号)。
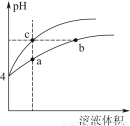
(2)某温度下,pH均为4的盐酸和醋酸溶液分别加水稀释,其pH随溶液体积变化的曲线图中a、b、c三点对应的溶液中水的电离程度由大到小的顺序是 ;该醋酸溶液稀释过程中,下列各量一定变小的是 。
a.c(H+) b.c(OH-)
c.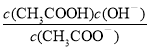 d.
d.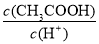
(3)以0.10 mol·L-1NaOH为标准液,测定某盐酸的浓度。取20.00 mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
实验编号 | 氢氧化钠溶液的浓度 (mol·L-1) | 滴定完成时,氢氧化钠溶液滴入的体积(mL) | 待测盐酸的体积(mL) |
1 | 0.10 | 24.12 | 20.00 |
2 | 0.10 | 23. 88 | 20.00 |
3 | 0.10 | 24.00 | 20.00 |
①滴定达到终点的标志是___________________________________________。
②根据上述数据,可计算出该盐酸的浓度约为__________________。
(4)在t℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12,则:
①该温度下水的离子积常数Kw= mol2·L-2。
②在该温度下,将100mL0.1 mol·L-1的稀H2SO4与100mL0.4 mol·L-1的NaOH溶液混合后,溶液的pH= 。
(1)①HCO3— + H2O 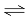 H2CO3 + OH—(2分)②dcab(2分)
H2CO3 + OH—(2分)②dcab(2分)
(2)b=c>a(2分) ad(2分)
(3)①滴入最后一滴NaOH溶液,溶液由无色恰好变成浅红色且半分钟内不褪色(2分)
②0.12 mol·L-1 (2分)
(4)①10-12 (2分)②11 (2分)
【解析】
试题分析:(1)HCO3—既能水解也能电离,水解方程式为HCO3— + H2O 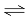 H2CO3 + OH—,水解呈碱性,电离方程式为HCO3—
H2CO3 + OH—,水解呈碱性,电离方程式为HCO3—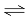 CO32-+ H+电离呈酸性,电离程度小于水解程度所以溶液呈碱性;氢氧化钠、氢氧化钡为强碱,、氢氧化钡中OH—的浓度比氢氧化钠大,所以PH氢氧化钡大于氢氧化钠;碳酸钠、醋酸钠为强碱弱酸盐,碳酸根水解程度大于醋酸根离子水解,所以碳酸钠溶液的PH大于醋酸钠;(2)对于酸溶液,PH越小对水的电离的抑制作用越大,所以水的电离程度由大到小的顺序是b=c>a;醋酸溶液加水稀释,c(H+)减小,KW不变,所以c(OH-)增大;
CO32-+ H+电离呈酸性,电离程度小于水解程度所以溶液呈碱性;氢氧化钠、氢氧化钡为强碱,、氢氧化钡中OH—的浓度比氢氧化钠大,所以PH氢氧化钡大于氢氧化钠;碳酸钠、醋酸钠为强碱弱酸盐,碳酸根水解程度大于醋酸根离子水解,所以碳酸钠溶液的PH大于醋酸钠;(2)对于酸溶液,PH越小对水的电离的抑制作用越大,所以水的电离程度由大到小的顺序是b=c>a;醋酸溶液加水稀释,c(H+)减小,KW不变,所以c(OH-)增大;
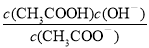
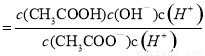
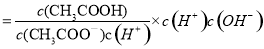 ,所以
,所以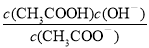 不变;
不变;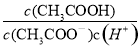 为常数,醋酸溶液加水稀释,
为常数,醋酸溶液加水稀释,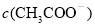 减小,所以
减小,所以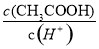 变小;(3)酚酞在盐酸中呈无色,滴加氢氧化钠溶液,溶液PH增大,滴入最后一滴NaOH溶液,溶液由无色恰好变成浅红色且半分钟内不褪色,达到滴定终点;三次滴定,消耗的氢氧化钠溶液的体积平均为24mL,根据
变小;(3)酚酞在盐酸中呈无色,滴加氢氧化钠溶液,溶液PH增大,滴入最后一滴NaOH溶液,溶液由无色恰好变成浅红色且半分钟内不褪色,达到滴定终点;三次滴定,消耗的氢氧化钠溶液的体积平均为24mL,根据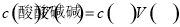 ;可得盐酸的浓度为0.12 mol·L-1;(4)①Kw=
;可得盐酸的浓度为0.12 mol·L-1;(4)①Kw=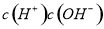 =
= ;②溶液混合后呈碱性,
;②溶液混合后呈碱性,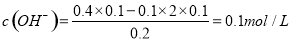 ,
,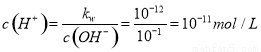 ;所以PH=11.
;所以PH=11.
考点:本题考查盐的水解、弱电解质电离、中和滴定。


 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源:2014-2015学年山西省高一上学期第一次考试化学试卷(解析版) 题型:填空题
(10分)已知A、B、C、D四种物质具有以下物理性质:
| A | B | C | D |
分散到水中 | 得悬浊液 | 得无色溶液 | 液体分层,且下层为无色油状液体 | 得无色溶液 |
熔点(℃) | 1452 | -21.3 | -11.5 | 801 |
沸点(℃) | 1703 | 78.9 | 117 | 1210 |
(1)已知A与D不发生反应,且均不与水反应。
①.欲从A、D的混合物中分离提纯D,需进行的操作是:
a:溶解;b: (填操作名称,下同);c: 。
②上述a、b、c操作过程中均需用到的一种玻璃仪器为_____;从B的水溶液中分离出B的操作名称为 。
(3)从C与水的混合物中分离提纯C所需的玻璃仪器有_______
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西省高二10月月考化学试卷(解析版) 题型:选择题
升高温度时,化学反应速率加快,主要原因是
A.分子运动速率加快,使该反应物分子的碰撞机会增多
B.反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多
C.该化学反应的过程是吸热的
D.该化学反应的过程是放热的
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西大学附中第一学期高二化学试卷(解析版) 题型:选择题
在乙酸、乙醇和浓硫酸混合物中,加入H218O,过一段时间后,18O存在于( )
A.只存在于乙酸分子中 B.存在于乙酸和乙酸乙酯中分子中
C.只存在于乙醇分子中 D.存在于水和乙酸分子中
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西大学附中第一学期高二化学试卷(解析版) 题型:选择题
决定化学反应速率的主要因素是
A、反应物的浓度 B、反应温度 C、使用催化剂 D、反应物的性质
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省潍坊三县市高二上学期联考化学试卷(解析版) 题型:选择题
下列事实或操作与盐类水解无关的是
A.配制FeC13溶液时,要滴加少量的盐酸
B.加热蒸干并灼烧Na2SO3溶液,得到Na2SO4固体
C.明矾净水
D.氨态氮肥(含NH4+)不能与草木灰混合使用
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省潍坊三县市高二上学期联考化学试卷(解析版) 题型:选择题
常温下,下列各组离子在有一定关限定条件下的溶液中一定能大量共存的是
A.由水电离产生的c(H+)=10-12 mol·L一1的溶液中:K+、Na+、Fe2+、NO3-
B.常温下,pH=7的溶液中: Al3+、Cl-、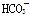 、SO42-
、SO42-
C.常温下,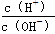 =1×10-12的溶液:K+、Cu2+、S2-、Cl-
=1×10-12的溶液:K+、Cu2+、S2-、Cl-
D.pH=13的溶液中:K+、Ba2+ 、Cl-、OH-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省潍坊三县市高一上学期联考化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.碳酸钙与盐酸反应:CO32-+2H+===H2O+CO2↑
B.硫酸氢钠溶液中加入足量的烧碱溶液:HSO4-+OH-=== SO42-+H2O
C.过氧化钠与水反应:2O22-+2H2O===4OH- + O2↑
D.澄清石灰水中通入少量二氧化碳:Ca2++2OH-+CO2===CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省乐陵市高二上学期期中考试化学试卷(解析版) 题型:选择题
一定量的气体在密闭容器中发生反应:xA(g) + yB(g)  zC(g),平衡时测得A的浓度为1.0mol/L,保持温度不变,将容器的容积扩大到原来的2倍,达新平衡后, 测得A的浓度降低为0.60 mol/L。下列有关判断正确的是
zC(g),平衡时测得A的浓度为1.0mol/L,保持温度不变,将容器的容积扩大到原来的2倍,达新平衡后, 测得A的浓度降低为0.60 mol/L。下列有关判断正确的是
A.平衡向正反应方向移动
B.物质B的转化率降低
C.x + y < z
D.物质C的体积分数增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com