
【题目】通过溶解、过滤、蒸发等操作,可将下列各组固体物质分离的是()
A. 氯化钾 碳酸钙 B. 氧化铜 二氧化锰
C. 硝酸钠 氢氧化钠 D. 硫酸铜 氢氧化钙
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】榄香烯是一种新型的抗癌药,它的结构简式如图,有关说法正确的是( ) 
A.榄香烯的分子式为C15H20
B.榄香烯属于芳香烃
C.1 mol 榄香烯最多能和3 mol H2反应
D.榄香烯不能使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组用如图1装置进行实验,试回答下列问题. 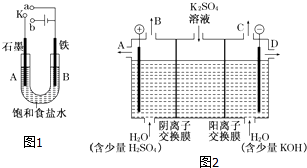
(1)若开始时开关K与a连接,则B极的电极反应式为 .
(2)若开始时开关K与b连接,则B极的电极反应式为 , 有关上述实验,下列说法正确的是(填序号) . ①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
③反应一段时间后通入适量HCl可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24L气体,则溶液中转移0.1mol电子
(3)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图2装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾. ①该电解槽的阳极反应式为 . 此时通过阴离子交换膜的离子数(填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数.
②制得的氢氧化钾溶液从出口(填写“A”、“B”、“C”或“D”)导出.
③若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一隔热系统中,向20.00mL 0.01000molL﹣1的醋酸溶液中逐滴加入0.01000mol.L﹣1的NaOH溶液,测得混合溶液的温度变化如图.下列相关说法正确的是( ) 
A.若a点溶液呈酸性,则a点有:c(CH3COO﹣)>c(Na+)>c(CH3COOH)
B.从b到c: ![]() 逐渐增大
逐渐增大
C.水的电离程度:b点<c点
D.b点有0.01000mol?L﹣1+c(H+)=c(Na)+﹣c(CH3COOH)+c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增.R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子.工业上通过分离液态空气获得X单质.Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和.Z基态原子的最外能层只有一个电子,其他能层均已充满电子.请回答下列问题:
(1)Z2+基态核外电子排布式为 .
(2)YX4﹣的空间构型是;与YX4﹣互为等电子体的一种分子为(填化学式);HYX4酸性比HYX2强,其原因是 .
(3)结构简式为RX(W2H3)2的化合物中R原子的杂化轨道类型为;1molRX(W2H3)2分子中含有σ键数目为 .
(4)往Z的硫酸盐溶液中通入过量的WH3 , 可生成[Z(WH3)4]SO4 , 下列说法正确的是 .
A.[Z(WH3)4]SO4中所含的化学键有离子键、极性键和配位键
B.在[Z(WH3)4]2+中Z2+给出孤对电子,WH3提供空轨道
C.[Z(WH3)4]SO4组成元素中第一电离能最大的是氧元素
(5)某Y与Z形成的化合物的晶胞如图所示(黑点代表Z原子). 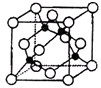
①该晶体的化学式为 .
②已知Z和Y的电负性分别为1.9和3.0,则Y与Z形成的化合物属于(填“离子”、“共价”)化合物.
③已知该晶体的密度为ρg.cm﹣3 , 阿伏伽德罗常数为NA , 则该晶体中Z原子和Y原子之间的最短距离为pm(只写计算式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的有()个
①将铁屑放入稀HNO3中,证明Fe比H2活泼
②FeCl3腐蚀Cu 制印刷电路板是由于铁比铜的金属性强
③检验溶液中是否含有Fe2+,取少量待检验溶液,向其中加入少量新制氯水,再滴加KSCN 溶液,观察实验现象
④磁性氧化铁溶于稀硝酸的离子方程式为:3Fe2++4H++NO3-==3Fe3++NO↑+3H2O
⑤将NaOH浓溶液滴加到饱和的FeCl3溶液中,制备Fe(OH)3胶体
⑥氢氧化铁与HI溶液反应的离子方程式为: Fe(OH)3+3H+==Fe3++3H2O
⑦铁与水蒸气在高温下的反应产物为Fe2O3 和H2
⑧1mol FeI2与足量氯气反应时转移的电子数为3NA
⑨检验Fe (NO3)2晶体是否氧化变质的方法是将Fe (NO3) 2样品溶于稀H2SO4后,滴加KSCN 溶液,观察溶液是否变红
⑩图示装置能较长时间观察到Fe (OH) 2白色沉淀
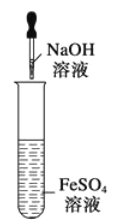
A. 1 B. 2 C. 3 D. 4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是 ( )
A. 烧碱、纯碱、熟石灰均属于碱,稀豆浆、FeCl3溶液、蛋白质溶液均属于胶体
B. SO2、NO2、CO2等非金属氧化物都是酸性氧化物
C. 碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物
D. 葡萄糖溶液和淀粉溶液的本质区别是能否产生丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:AgCl、AgBr及AgI的Ksp依次为1.6×10﹣10、4.8×10﹣13和1.6×10﹣16 , 现将物质的量均为1.5×10﹣2mol的NaI,NaBr、NaCl和4.0×10﹣2mo1AgNO3混合配成1.0L水溶液,达到平衡时,下列说法正确的是( )
A.只生成AgBr及AgI两种沉淀
B.溶液中c(I﹣)≈1.0×10﹣9mol/L
C.溶液中c(Br﹣)≈3.0×10﹣5mol/L
D.溶液中c(Ag+)≈3.2×10﹣8mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组根据镁与沸水的反应推测镁也能与饱和碳酸氢钠溶液反应.资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物.该兴趣小组设计了如下实验方案验证产物并探究反应原理.
实验1:用砂纸擦去镁条表面氧化膜,将其放人盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变红.
(1)提出假设
该同学对反应中产生的白色不溶物作出如下假设:
假设1:可能为 .
假设2:可能为MgCO3 .
假设3:可能是碱式碳酸镁[xMgCO3yMg(OH)2]
(2)设计定性实验确定产物并验证猜测:
实验序号 | 实验 | 预期现象和结论 |
实验Ⅱ | 将实验I中收集到的气体点燃 | ① |
实验Ⅲ | 取实验I中的白色不溶物,洗涤,加入足量② | 产生气泡,沉淀全部溶解;白色不溶物可能含有MgCO3 |
实验Ⅳ | 取实验I中的澄清液,向其中加入少量CaCl2溶液 | 产生白色沉淀;溶液中存在③离子 |
(3)设计定量实验确定实验I的产物:称取实验Ⅰ中所得干燥、纯净的白色不溶物6.20g,充分加热灼烧至不再产生气体为止,并使分解产生的气体全部进入装置A(盛足量浓硫酸)和B(盛足量碱石灰)中.实验前后装置A增重0.36g,装置B增重2.64g,则白色不溶物的化学式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com