
【题目】过氧化钙是白色结晶,用做杀菌剂、防腐剂、解酸剂、油类漂白剂及封闭胶泥的快干剂。在食品、牙粉和化妆品等制造中用作添加剂,也可用作氧化物阴极材料。农业上用作种子及谷物的无毒性消毒剂。可作为水产养殖中广泛使用的供氧剂。
(1)过氧化钙制备方法很多
①制备方法一:氢氧化钙与60%的过氧化氢在催化剂存在下反应而得,其化学方程式为_____________。
②制备方法二:利用反应CaCl2+H2O2+2NH3·H2O+6H2O= CaO2·8H2O+2NH4Cl。在碱性环境中制取CaO2。NH3·H2O在Ca2+和H2O2的反应中所起的作用是_______________________; 该反应需要在冰水浴条件下完成,原因是________________________。
③制备方法三:利用反应Ca(s)+O2![]() CaO(s),在纯氧条件下制取CaO2,实验室模拟装置示意图如图所示:
CaO(s),在纯氧条件下制取CaO2,实验室模拟装置示意图如图所示:

请回答下列问题:
装置A中发生反应的化学方程式为_______________;装置D中盛有的液体是浓硫酸,其作用一是观察氧气的流速,判断氧气通入是否过快及氧气与钙反应进行的程度;二是_________________。
(2)水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg·L-1。测定原理为碱性条件下,O2将Mn2+氧化为MnO(OH)2:2Mn2++O2+4OH-=2MnO(OH)2↓;酸性条件下,MnO(OH)2将I-氧化为I2:MnO(OH)2+2I-+4H+=Mn2++I2+3H2O;用Na2S2O3标准溶液滴定生成的I2:2S2O32-+I2=S4O62-+2I-。取加过一定量 CaO2·8H2O的池塘水样100.0mL,按上述方法测定水中的溶氧量,消耗0.01000mol·L-1Na2S2O3标准溶液13.50mL。滴定过程中使用的指示剂是 ___________;该水样中的溶解氧量(DO)为_______________。
【答案】 ①Ca(OH)2+H2O2=CaO2+2H2O 中和过氧化氢和Ca2+反应产生的氢离子,促进反应的进行(或中和反应生成的HCl,使反应CaCl2+H2O2= CaO2+2HCl) (向右进行) 防止H2O2发生分解 2H2O2![]() 2H2O+O2↑ (或2Na2O2+2H2O=4NaOH+O2↑) 防止空气进入C装置影响产品纯度 淀粉溶液 10.80mg·L-1
2H2O+O2↑ (或2Na2O2+2H2O=4NaOH+O2↑) 防止空气进入C装置影响产品纯度 淀粉溶液 10.80mg·L-1
【解析】(1)①氢氧化钙与60%的过氧化氢在催化剂存在下反应生成过氧化钙和水,类似复分解反应,化学方程式为Ca(OH)2+H2O2=CaO2+2H2O;②中和过氧化氢和Ca2+反应产生的氢离子,促进反应的进行(或中和反应生成的HCl,使反应CaCl2+H2O2= CaO2+2HCl) (向右进行);双氧水受热易分解,在冰水浴条件下可防止H2O2发生分解;③装置A是制备氧气的发生装置,应是双氧水分解反应,化学方程式为2H2O2![]() 2H2O+O2↑ (或2Na2O2+2H2O=4NaOH+O2↑) ;因过氧化钙易与水反应,整个制备应干燥纯氧条件下进行,D装置可以防止空气进入C装置影响产品纯度。
2H2O+O2↑ (或2Na2O2+2H2O=4NaOH+O2↑) ;因过氧化钙易与水反应,整个制备应干燥纯氧条件下进行,D装置可以防止空气进入C装置影响产品纯度。
用Na2S2O3标准溶液滴定生成的I2,可以用淀粉溶液作为滴定终点判断的现象依据;由方程式找出关系式(电子守恒)为:O2——2MnO(OH)2——2 I2——4 S2O32—,代入计算:
所以该水样中的溶解氧为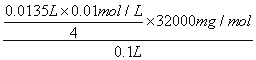 =10.80mg/L。
=10.80mg/L。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温下,向20.00mL0.1000mol/L的氨水中逐滴加入0.100mol/L的盐酸,pH随盐酸体积的变化如图所示(不考虑NH3的逸出)。下列说法不正确的

A. 反应过程中: c(NH4+)+c(H+)=c(OH-)+c(Cl-)
B. V(HCl)=10.00mL时,c(NH3·H2O)>c(NH4+)>c(Cl-)
C. V(HCl)<20.00mL时,溶液不一定呈碱性
D. v(HCl)=30.00mL时,2c(Cl-)=3c(NH4+)+3c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将盛有15mLNO2的试管倒置于水中,充分反应(3NO2+H2O = 2HNO3 + NO)后,试管内剩下气体的体积为(同温同压下测定)( )
A. 0mL B. 2.5mL C. 5mL D. 7.5mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.很多鲜花和水果的香味来自于酯
B.裂化、裂解、分馏均属于化学变化
C.糖类和油脂在一定条件下均能水解
D.棉花和蚕丝的主要成分是纤维素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于离子键和离子化合物的说法正确的是( )
A. 阴、阳离子通过静电引力形成离子键
B. 阴、阳离子间通过离子键一定能形成离子化合物
C. 离子化合物一定能导电
D. 只有在活泼金属元素和活泼非金属元素化合时,才能形成离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
A. 碳酸钠比碳酸氢钠易溶于水
B. 碳酸钠比碳酸氢钠稳定
C. 碳酸钠和碳酸氢钠能跟石灰水反应得到白色沉淀
D. 等质量的碳酸钠和碳酸氢钠分别与足量盐酸反应,得到相同质量的二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氨水的叙述中,不正确的是( )
A. 氨水具有弱碱性 B. 氨水和液氨成分相同
C. 氨水中共有6种粒子 D. 氨水中一水合氨的物质的量浓度最大(除水外)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、水的电离平衡曲线如图所示。

(1)若以A点表示25℃时水的电离平衡的离子浓度,当温度升高到100℃时,水的电离平衡状态移动到B点,则此时水的离子积从________变化到_________。
(2)将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100℃的恒温,致使混合溶液的pH=7,则Ba(OH)2和盐酸的体积比为__________________。
Ⅱ、有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含一种阴离子且互不重复):阳离子 Na+、Ba2+、NH4+ 阴离子 CH3COO-、Cl-、OH-、SO42-。已知:①A、C溶液的pH均大于7,A、B的溶液中水的电离程度相同;②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无明显现象。
①A是__________________,B是 __________________。
②用离子方程式表示A溶液呈碱性的原因__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com