
【题目】氢气是一种重要的清洁能源。
(1)航天员呼吸产生的![]() 利用
利用![]() 反应:
反应:![]() H,再电解水可实现
H,再电解水可实现![]() 的循环利用。
的循环利用。
①热力学中规定,由最稳定单质生成![]() 某物质的焓变称为该物质的标准生成焓(符号:
某物质的焓变称为该物质的标准生成焓(符号:![]() ),最稳定单质的标准生成焓规定为0。已知上述反应式中:
),最稳定单质的标准生成焓规定为0。已知上述反应式中:
![]() ;
;![]() ;
;![]() ;
;
![]() ;则
;则![]() _____
_____![]() 。
。
②![]() 反应必须在高温下才能进行,原因是___________________________。
反应必须在高温下才能进行,原因是___________________________。
③350℃时,向体积为![]() 的恒容密闭容器中通入
的恒容密闭容器中通入![]() 和
和![]() 发生以上反应。
发生以上反应。
测得反应过程中压强随时间的变化如下表所示:
时间/ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
压强 |
|
|
|
|
|
|
|
350℃时![]() 反应的
反应的![]() ______(
______(![]() 为用气体的分压代替各组分平衡浓度表示的平衡常数,气体分压=气体的体积分数×体系总压)。
为用气体的分压代替各组分平衡浓度表示的平衡常数,气体分压=气体的体积分数×体系总压)。
(2)利用乙醇重整制氢是获得氢能的研究热点,其主要反应原理为:
反应Ⅰ: ![]() H1
H1
若同时通入水蒸汽,还会发生如下反应
反应Ⅱ:![]() H2
H2
反应Ⅲ:![]() H3
H3
反应Ⅳ:![]() H4
H4
一定温度下,某恒压密闭容器中充入一定量的![]() 发生反应。
发生反应。
已知:氢气选择性指转化的原料气中,转化成氢气的氢元素质量与转化的氢元素总质量的比值。
①下列有关说法正确的是_______________。
A.当混合气的平均相对分子质量不变时,说明反应达到平衡状态
B.增大乙醇初始浓度,能够提高乙醇的平衡转化率
C.其它条件不变,掺入稀有气体,可提高乙醇平衡转化率
D.其它条件不变,掺入水蒸气,可提高氢气的选择性和氢气的体积分数
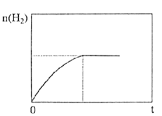
②下图为上述条件下n(H2)随反应时间的变化曲线图。若其它初始条件相同,只把容器变为恒容密闭容器,请画出恒容条件下,n(H2)随反应时间的变化曲线图________________。
③乙醇重整制氢过程中,还可能生成固态炭,固态炭的生成会造成催化剂失活,应尽量避免。研究其它条件相同下,反应温度、氧醇比、水醇比与生成固态炭的条件,得到下图:
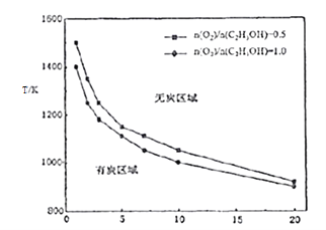
试根据图象分析,反应温度、氧醇比、水醇比对固态炭生成的影响_____________。
【答案】-90 反应的活化能高 ![]() AC
AC 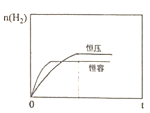 在其它条件相同的情况下,升高温度或增大水醇比、增大氧醇比均会减少固态炭的生成。
在其它条件相同的情况下,升高温度或增大水醇比、增大氧醇比均会减少固态炭的生成。
【解析】
计算反应的焓变时,应将生成物的焓变减去反应物的焓变;对于一个反应,不管是吸热反应还是放热反应,都需要提供能量引发反应,反应的活化能越高,所需能量越大;用分压表示平衡常数时,可利用三段式,先求出平衡时各物质的分压,再代入平衡常数计算公式。对于可逆反应,分析平衡混合气的相对分子质量变化时,需要考察气体的总质量和总物质的量的变化;判断反应物的转化率时,需考虑平衡移动的方向;判断产物中H2的体积分数时,不能只考虑生成物中H2的含量,还需考虑反应物的转化率。分析图象时,一方面需考虑条件改变引起反应时间的改变,另一方面需考虑平衡移动的方向;分析条件改变对某产物产量的影响时,需从图象分析入手,找出理想的区域,从而得出适宜的条件。
(1)①![]() 反应:
反应:![]() H
H
![]() ;
;![]() ;
;![]() ;
;
![]() ;则H =2
;则H =2![]() -
-![]() =2×(-242kJmol-1)-(-394 kJmol-1)= -90 kJmol-1。答案为:-90;
=2×(-242kJmol-1)-(-394 kJmol-1)= -90 kJmol-1。答案为:-90;
②反应时提供的条件,是为了克服反应的活化能,![]() 反应必须在高温下才能进行,原因是反应的活化能高。答案为:反应的活化能高;
反应必须在高温下才能进行,原因是反应的活化能高。答案为:反应的活化能高;
③设参加反应的CO2物质的量为x,利用已知数据可建立如下三段式:
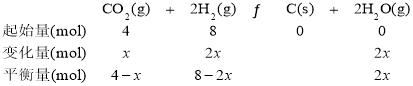
则![]() ,x=2mol,350℃时
,x=2mol,350℃时![]() 反应的Kp=
反应的Kp=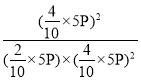 =
=![]() 。答案为:
。答案为:![]() ;
;
(2)①A.随着反应的进行,混合气的质量不变,物质的量不断改变,当混合气的平均相对分子质量不变时,物质的量保持不变,说明反应达到平衡状态,A符合题意;
B.增大乙醇初始浓度,相当于加压,平衡逆向移动,乙醇的平衡转化率降低,B不合题意;
C.其它条件不变,掺入稀有气体,由于容器的压强不变,气体的体积增大,反应混合气的浓度减小,相当于减压,平衡正向移动,乙醇平衡转化率提高,C符合题意;
D.其它条件不变,掺入水蒸气,反应物中的氢元素都转化为H2,可提高氢气的选择性,但各可逆反应的转化率未知,所以氢气的体积分数不一定增大,D不合题意;
故选AC。答案为:AC;
②若其它初始条件相同,只把容器变为恒容密闭容器,由于生成物的气体分子数大于反应物的气体分子数,所以相当于原容器加压,反应速率加快,达平衡的时间缩短,但平衡逆向移动,n(H2)减小,故恒容条件下,n(H2)随反应时间的变化曲线图为 。答案为:
。答案为: ;
;
③从图象中可以看出,温度一定时,增大氧醇比、水醇比,会减少固态炭生成;氧醇比、水醇比一定时,升高温度,会减少固态炭生成,所以反应温度、氧醇比、水醇比对固态炭生成的影响:在其它条件相同的情况下,升高温度或增大水醇比、增大氧醇比均会减少固态炭的生成。答案为:在其它条件相同的情况下,升高温度或增大水醇比、增大氧醇比均会减少固态炭的生成。


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】在常温下的一密闭容器中事先放入1.56g过氧化钠,然后再通入乙烷与氧气的混合气体,用电火花引爆,直至反应完全为止,恢复到原温度,容器内压强近似为零。
(1)相同条件下,通入的气体氧气和乙烷的体积比是多少?_____
(2)通入氧气的质量最大应是多少?_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铁钉在氯气中被锈蚀为棕褐色物质FeCl3,而在盐酸中生成浅绿色的FeCl2溶液。在Cl2、Cl-、H+中,具有氧化性的是____________,其中氧化性最强的是____________。
(2)盐酸在不同的反应中可以分别表现出酸性、氧化性和还原性。现在有如下三个反应,请写出盐酸在三个反应中分别起何种作用:
①Zn+2HCl===ZnCl2+H2↑____________________;
②NaOH+HCl===NaCl+H2O__________________;
③2HCl![]() H2↑+Cl2↑________________________。
H2↑+Cl2↑________________________。
(3)铁钉在氯气中被锈蚀成棕褐色物质FeCl3,而在盐酸中生成浅绿色溶液(FeCl2);向浓盐酸中滴加KMnO4溶液产生淡黄绿色气体(Cl2)。在Cl2、H+、![]() 中,__________________氧化性最强。
中,__________________氧化性最强。
(4)高锰酸钾与氢溴酸溶液可以发生下列反应:2KMnO4+16HBr===5Br2+2MnBr2+2KBr+8H2O。其中还原剂是________________。若消耗15.8 g氧化剂,则被氧化的还原剂的质量是______________g。HBr的作用是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究化学反应中能量变化,能更好地利用化学反应为生产和生活服务。
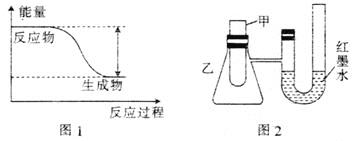
(1)反应Fe+H2SO4=FeSO4+H2↑的能量变化如图1所示。
①该反应为 __________(填“吸热”或“放热”)反应。
②为了探究化学能与热能的转化,某实验小组设计了图2实验装置,在甲试管里先加入适量铁片,再加入稀硫酸,U形管中可观察到的现象是__________。
③若要使该反应的反应速率加快,下列措施可行的是__________(填字母)。
A.铁片改为铁粉 B.稀硫酸改为98%的浓硫酸 C.升高温度
(2)若将上述反应设计成原电池,装置如图3所示。
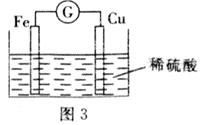
①铜为 __________(填“正”或“负”)极;负极的电极反应式为______。
②若该电池反应过程中共转移0.3 mol电子,则生成的H2在标准状况下的体积是__________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物X,含有NaClO3、KCl、NaOH、ZnSO4、NaAl(OH)4和NaNO2中的几种,进行如下实验:①X溶于水,得到溶液Y;②溶液Y先加入过量稀HNO3酸化,再加入AgNO3溶液,得到白色沉淀W,下列说法不正确的是( )
A.混合物X中可能含有KCl
B.向溶液Y中滴加盐酸,若产生白色沉淀,说明X中一定含有NaAl(OH)4
C.向溶液Y中滴加盐酸,若产生红棕色的气体,说明X中一定含有NaNO2
D.取X溶液进行焰色反应,透过蓝色钴玻璃片没有观察到紫色火焰,说明X中一定含有NaClO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)比较熔点:![]() 晶体_______白磷晶体(填“>”、“<”或“=”),判断的理由是_______________;
晶体_______白磷晶体(填“>”、“<”或“=”),判断的理由是_______________;
(2)酸碱质子理论认为,能电离出质子(氢离子)的物质是酸,能结合质子的物质是碱,用一个离子方程式说明:![]() 与
与![]() 的碱性强弱________________;
的碱性强弱________________;
(3)一水合氨![]() 分子中,
分子中,![]() 与
与![]() 实际上是通过氢键相结合,请结合一水合氨的性质,用结构式画出一水合氨最有可能的分子结构____________。
实际上是通过氢键相结合,请结合一水合氨的性质,用结构式画出一水合氨最有可能的分子结构____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将定量的Na2CO3和NaHCO3的混合物加热到不再放出气体时,收集到CO2aL,冷却后向残余物中加入足量盐酸又收集到CO2 2 aL (体积均在标准状况下测定)。则混合物中Na2CO3和NaHCO3的物质的量之比为( )
A. 1:1 B. 1:2 C. 1:3 D. 1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)化合物A是一种不稳定的物质,它的分子组成可用OxFy表示。10mLA气体 能分解生成15mLO2和10mLF2(在同温同压下),A的化学式是_____。
(2)VLFe2(SO4)3溶液中含有agSO42-,取此溶液0.5VL,用水稀释至2VL,则稀释后溶液中 Fe3+的物质的量的浓度为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、工业上制硫酸的主要反应之一为2SO2(g)+O2(g)![]() 2SO3(g),反应过程中能量的变化如图所示。
2SO3(g),反应过程中能量的变化如图所示。
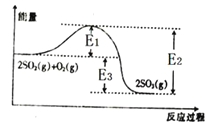
(1)由图可知该反应的正反应为_______(填“吸热”或“放热”)反应。
(2)向反应体系中加入催化剂后,图中E1_____(填“增大”“减小”或“不变”,下同),E3______。
Ⅱ、如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中,试回答下列问题:
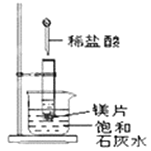
(3)写出试管内反应的离子方程式___________________________;
(4)实验中观察到石灰水中的现象:Ⅰ镁片溶解、Ⅱ镁片上产生大量气泡、Ⅲ_________________,产生上述现象Ⅲ的原因是____________________________。
(5)由实验推知,MgCl2溶液和H2的总能量______(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com