

| V×10-3 |
| a |
| 2V×10-3 |
| a |
| ||
| mg |
| 0.156V |
| am |
| 15.6V |
| am |


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
| A、硫酸铁中加入少量氨水:Fe3++3OH-═Fe(OH)3↓ |
| B、电解饱和食盐水:2Cl-+2H2O=H2↑+Cl2↑+2OH- |
| C、碳酸钙与盐酸反应:CO32-+2H+═CO2↑+H2O |
| D、铁跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 | I5 |
| Y | 584 | 1823 | 2751 | 11584 | 14837 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
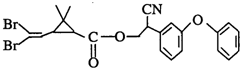 则下列对该化合物叙述正确的是( )
则下列对该化合物叙述正确的是( )| A、属于芳香烃 |
| B、属于卤代烃 |
| C、在酸性和碱性条件下都不能水解 |
| D、在一定条件下可以发生加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com