
【题目】化学用语在化学学科中作用非常重要,以下有关化学用语描述正确的是( )
A.Mg2+的电子排布式:1s22s22p63s2
B.氨气的空间结构:三角形
C.Na2S的电子式:![]()
D.甲醛的结构简式:CH2O
科目:高中化学 来源: 题型:
【题目】下列大小关系正确的是
A.熔点:己烷>2-甲基丁烷>戊烷>丁烷
B.含氢量:甲烷>乙烷>乙烯>乙炔>苯
C.密度:苯>H2O>CCl4
D.相同物质的量物质完全燃烧耗氧量:己烷>环己烷>苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入CH4与CO2,使其物质的量浓度均为1.0 mol·L-1,在一定条件下发生反应:CO2(g)+CH4(g)2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图所示:
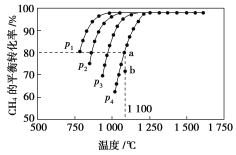
则:(1)该反应的ΔH________0(填“<”“=”或“>”)。
(2)压强p1、p2、p3、p4由大到小的顺序为______________。压强为p4时,在b点:v(正)________v(逆)(填“<”“=”或“>”)。
(3)对于气相反应,用某组分(B)的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数(记作Kp),则该反应的平衡常数的表达式Kp=________;如果p4=0.36 MPa,求a点的平衡常数Kp=________ (保留3位有效数字,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)为探究速率与浓度的关系,该实验中,根据相关实验数据,粗略绘制出了2条速率—浓度关系曲线:v正~c(CH4)和v逆~c(CO)。
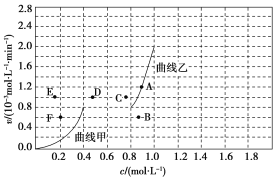
则:①与曲线v正~c(CH4)相对应的是上图中曲线______(填“甲”或“乙”)。
②当降低到某一温度时,反应重新达到平衡,相应的平衡点分别为________(填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质:①铜片 ②![]() ③
③![]() ④
④![]() ⑤
⑤![]() ⑥
⑥![]() ⑦
⑦![]() ⑧氨水。
⑧氨水。
(1)把上述各物质按物质分类方法填写在下表的空白处(填物质编号)
分类标准 | 碱性氧化物 | 非电解质 | 弱酸 |
属于该类的物质 | ___________ | ___________ | ______________ |
(2)把上述各物质按物质分类方法填写在下表的空白处(填物质编号)。
(3)在标准状况下,相同体积的②和④,其原子个数比为_________。
(4)写出氢氧化钡的电离方程式:______________。
(5)上述物质中有两种物质之间可发生离子反应:![]() ,该离子反应对应的化学方程式为:______________。
,该离子反应对应的化学方程式为:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以甲苯为主要原料,采用以下路线合成化妆品防霉剂:对![]() 羟基苯甲酸乙酯。
羟基苯甲酸乙酯。
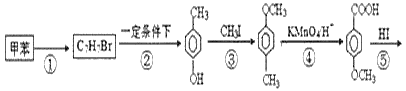
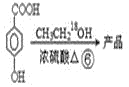
请回答:
(1)有机物C7H7Br的名称为___。
(2)产品的摩尔质量为___。
(3)在①~⑥的反应中属于取代反应的有___。
(4)![]() 在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式)___。
在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式)___。
(5)![]() 的同分异构体很多,其中符合下列条件有___种。
的同分异构体很多,其中符合下列条件有___种。
①遇到FeCl3溶液出现显色现象;②能发生水解反应;③能发生银境反应;④无-CH3结构。上述同分异构体中核磁共振氢谱显示其有5种峰的结构简式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某碳酸钠和碳酸氢钠的混合溶液中逐滴加入稀盐酸,加入稀盐酸的体积与标准状况下产生气体体积的关系如图所示。
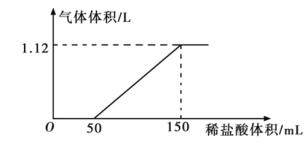
(1)生成![]() 气体的物质的量是多少?________________。
气体的物质的量是多少?________________。
(2)盐酸的物质的量浓度是多少?_____________。
(3)原溶液中碳酸钠与碳酸氢钠的物质的量之比是多少?_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题
(1)表中元素原子半径最大的原子共占据的轨道数是_________个,Y最外层电子排布式为________,Z原子核外有_____种能量不同的电子。
(2)下列事实能说明Y元素的非金属性比S元素的非金属性强的是__________
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
从原子结构的角度去解释Y元素的非金属性比S元素的非金属性强的原因:_______
(3)CO2的沸点_________CS2(填“>”或“<”或“=”),原因是_________________
(4)如果向BaCl2溶液中通入足量CO2气体,没有沉淀生成,继续滴加一定量的氨水后,则会生成白色沉淀。用电离平衡移动原理解释上述现象。________
(5)过量的CO2通入NaOH溶液中,得到NaHCO3,在0.1mol/L的NaHCO3溶液中,c(Na+)+c(H+)=________其中有关碳微粒的关系为:___________ = 0.1mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C是中学化学中最常见的三种有机物,D是高分子化合物,常用来制造食品和药品包装袋,已知这四种物质之间存在如图所示关系:
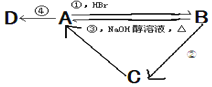
(1)写出反应类型:①___,③____,④____。
(2)反应②的条件是____。
(3)写出化学方程式:B→C:___,A→D:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年8月《Green Chemistry》报道了我国学者发明的低压高效电催化还原CO2的新方法,其总反应为NaCl+CO2![]() CO+NaClO。下列有关化学用语表示错误的是( )
CO+NaClO。下列有关化学用语表示错误的是( )
A.中子数为12的钠原子:![]() NaB.Cl-的结构示意图:
NaB.Cl-的结构示意图:![]()
C.CO2的结构式:O=C=OD.NaClO的电子式:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com