
【题目】以甲苯为主要原料,采用以下路线合成化妆品防霉剂:对![]() 羟基苯甲酸乙酯。
羟基苯甲酸乙酯。
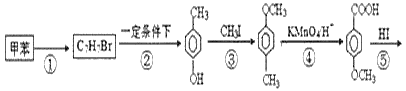
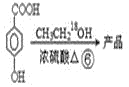
请回答:
(1)有机物C7H7Br的名称为___。
(2)产品的摩尔质量为___。
(3)在①~⑥的反应中属于取代反应的有___。
(4)![]() 在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式)___。
在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式)___。
(5)![]() 的同分异构体很多,其中符合下列条件有___种。
的同分异构体很多,其中符合下列条件有___种。
①遇到FeCl3溶液出现显色现象;②能发生水解反应;③能发生银境反应;④无-CH3结构。上述同分异构体中核磁共振氢谱显示其有5种峰的结构简式为___。
【答案】3-溴甲苯或对溴甲苯 168g/mol ①②③⑤⑥  +(n-1)H2O或
+(n-1)H2O或 +nH2O 3
+nH2O 3 ![]()
【解析】
甲苯发生反应生成B,B反应生成对甲基苯酚,根据甲苯和对甲基苯酚结构简式及B的分子式知,甲苯与溴发生甲基对位取代反应生成![]() ,在一定条件下发生水解反应生成
,在一定条件下发生水解反应生成![]() ,③的反应为取代反应,④为氧化反应、⑤为取代反应、⑥发生酯化反应生成产品,则产品的结构简式
,③的反应为取代反应,④为氧化反应、⑤为取代反应、⑥发生酯化反应生成产品,则产品的结构简式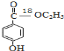 。
。
(1)由反应②的产物可判断C7H7Br分子中,溴原子的位置在甲基的对位,名称是3-溴甲苯或对溴甲苯;
(2)通过以上分析知,产物的结构简式为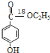 ,其摩尔质量为168g/mol;
,其摩尔质量为168g/mol;
(3)在①~⑥的反应中只有④是氧化反应,其余反应从反应前后的产物判断都是取代反应,故答案为:①②③⑤⑥;
(4)![]() 中含有羧基、羟基,发生缩聚反应生成
中含有羧基、羟基,发生缩聚反应生成![]() ,反应方程式为n
,反应方程式为n![]()
![]()
![]() +(n-1)H2O;或n
+(n-1)H2O;或n![]()
![]()
![]() +nH2O;
+nH2O;
(5)①遇到FeCl3溶液出现显色现象,说明分子中存在酚羟基;②能发生水解反应,说明分子中含有酯基,③能发生银境反应,说明存在醛基,④分子无-CH3结构,因此是甲酸某酯结构,苯环上有两个取代基,所以符合以上条件![]() 的同分异构体有邻、间、对3种,有5种氢原子的只能是对位结构,结构简式为
的同分异构体有邻、间、对3种,有5种氢原子的只能是对位结构,结构简式为![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】请把下列现象中浓硫酸表现出来的性质写填在对应的空白处:
(1)把浓硫酸滴在白纸上,白纸变黑,则浓硫酸表现___(填“脱水性”或“氧化性”);
(2)盛有浓硫酸的烧杯敞口放置一段时间,质量增加,则浓硫酸表现出___(填“吸水性”或“脱水性”);
(3)浓硫酸与碳共热时发生反应2H2SO4(浓)+C![]() CO2↑+2SO2↑+2H2O,在该反应中,浓硫酸表现出___(填“酸性”或“强氧化性”)。
CO2↑+2SO2↑+2H2O,在该反应中,浓硫酸表现出___(填“酸性”或“强氧化性”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯是一种用途广泛的精细化工产品。工业生产乙酸乙酯的方法很多,如图:

下列说法正确的是
A. 反应①、②均是取代反应
B. 反应③、④的原子利用率均为100%
C. 与乙酸乙酯互为同分异构体的酯类化合物有2种
D. 乙醇、乙酸、乙酸乙酯三种无色液体可用Na2CO3溶液鉴别
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A(C2H2)是基本有机化工原料。由A制备高分子降解塑料(PVB)和IR的合成路线(部分反应条件略去)如图所示:
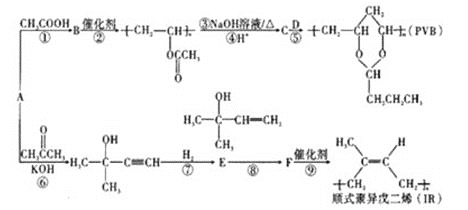
已知:①RCHO+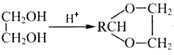 +H2O;
+H2O;
②RBr![]() RCOOH。
RCOOH。
试回答下列问题:
(1)过程①的反应类型为___,B中含氧官能团的名称是___。
(2)反应⑧的化学方程式为___。反应③的化学方程式为___。
(3)关于过程②,下列说法正确的是___(填序号)。
a.反应②属于缩聚反应
b.生成的高分子化合物还能与溴水反应而使其褪色
c.该高分子链节具有和其单体完全一样的结构
d.生成的高分子材料具有热塑性,且为混合物
e.通过质谱仪测得该高分子的平均相对分子质量为30444,可推知其n约为354
(4)F分子中最多有___个原子共平面,D的结构简式是___。
(5)G与E互为同分异构体,则G的所有同分异构体中含有碳碳双键的结构(包含E在内且不考虑顺反异构)共有___种。(已知碳碳双键与羟基直接相连不稳定,不考虑)
(6)利用题目信息,以乙烯为起始原料,选用必要的无机试剂合成丁二酸乙二酯,写出合成路线___(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸橙花酯是一种食用香料,其结构简式如图,关于该有机物的叙述中正确的是( )
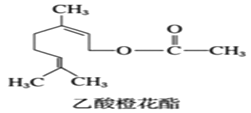
①分子式为C12H19O2;②不能发生银镜反应;③mol该有机物最多能与3mol氢气发生加成反应;④它的同分异构体中不可能有酚类;⑤1mol该有机物与NaOH溶液反应最多消耗1molNaOH;⑥属于芳香族化合物。
A.②④⑤B.①④⑤C.②③⑥D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学用语在化学学科中作用非常重要,以下有关化学用语描述正确的是( )
A.Mg2+的电子排布式:1s22s22p63s2
B.氨气的空间结构:三角形
C.Na2S的电子式:![]()
D.甲醛的结构简式:CH2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是日常生活中最常见的金属,其转化关系如图(部分反应物或生成物已略去)。
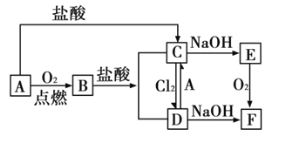
(1)写出![]() 的化学式_____________;溶液
的化学式_____________;溶液![]() 的颜色是______________。
的颜色是______________。
(2)写出下列转化的离子方程式:
①![]() :_________________。
:_________________。
②![]() :__________________。
:__________________。
(3)![]() 转化为
转化为![]() 过程中,可观察到白色沉淀迅速变成灰绿色,最后变成红褐色,该反应的化学方程式为:________________。
过程中,可观察到白色沉淀迅速变成灰绿色,最后变成红褐色,该反应的化学方程式为:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以前实验室制备纯碱(Na2CO3)的主要步骤为:将饱和NaCl溶液倒入烧杯加热,控制30—35℃,搅拌下分批加入研细的NH4HCO3固体,加料完毕,保温30分钟,静置、过滤得NaHCO3晶体。用少量蒸馏水洗涤除去杂质、抽干,转入蒸发皿中灼烧得Na2CO3固体。四种盐在不同温度下的溶解度表 (g/100g水)
温度 溶解度 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | — | — | — | — |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | — |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
①反应控制在30—35℃,是因为高于35℃NH4HCO3会分解,低于30℃则反应速率降低 ,为控制此温度范围,通常采取的加热方法为________________;
②加料完毕,保温30分钟,目的_________;
③过滤所得母液中含有NaHCO3、NaCl 、NH4Cl、NH4HCO3,加入适当试剂并作进一步处理,使_________________(填化学式)循环使用,回收得到NH4Cl晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物①在一定条件下可以制备②,下列说法错误的是
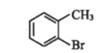 ①→
①→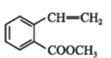 ②
②
A.①不易溶于水
B.①的芳香族同分异构体有3种(不包括①)
C.②在碱性条件下的水解是我们常说的皂化反应
D.②中所有碳原子可能共平面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com