
【题目】将3.48gFe3O4完全溶解在100mL 1mol·L-1H2SO4溶液中,然后加入K2Cr2O7溶液25mL,恰好使溶液中的Fe2+全部反应完,Cr2O72-全部转化为Cr3+,则K2Cr2O7溶液的物质的量浓度为
A.0.033mol·L—1B.0.3mol·L—1C.0.2mol·L—1D.0.1mol·L—1
科目:高中化学 来源: 题型:
【题目】我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献,他以饱和食盐水、![]() 、
、![]() 为原料先制得
为原料先制得![]() ,进而生产出纯碱。回答下列问题:某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计方案实验。一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如图所示
,进而生产出纯碱。回答下列问题:某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计方案实验。一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如图所示![]() 图中夹持、固定用的仪器未画出
图中夹持、固定用的仪器未画出![]() 。
。
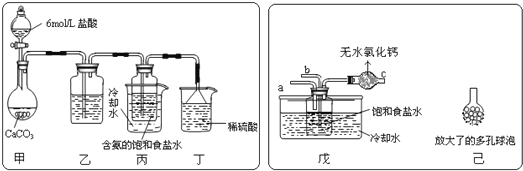
![]() 乙装置中的试剂是___________。丁装置中稀硫酸的作用是_________________。
乙装置中的试剂是___________。丁装置中稀硫酸的作用是_________________。
![]() 另一位同学用图中戊装置
另一位同学用图中戊装置![]() 其他装置未画出
其他装置未画出![]() 进行实验。实验时,须先从______管通入_____气体。
进行实验。实验时,须先从______管通入_____气体。
![]() 有同学建议在戊装置的b管下端连接己装置,理由是________________。
有同学建议在戊装置的b管下端连接己装置,理由是________________。
![]() 下表中所列出的是相关物质在不同温度下的溶解度数据
下表中所列出的是相关物质在不同温度下的溶解度数据![]() 水
水![]() :
:
0 | 10 | 20 | 30 | 40 | 50 | |
NaCl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
参照表中数据,请分析丙、戊装置中使用冷却水或者冰水的原因:____________。
![]() 该小组同学为了测定丙中所得晶体的碳酸氢钠的纯度
该小组同学为了测定丙中所得晶体的碳酸氢钠的纯度![]() 假设晶体中不含碳酸盐杂质
假设晶体中不含碳酸盐杂质![]() ,将晶体充分干燥后,称量质量为
,将晶体充分干燥后,称量质量为![]() 。再将晶体加热到质量不再变化时,称量所得粉末质量为
。再将晶体加热到质量不再变化时,称量所得粉末质量为![]() 。然后进行下图所示实验:
。然后进行下图所示实验:
![]()
①在操作Ⅱ中,为了判断加入氯化钙溶液是否过量,其中正确的是______![]() 填字母
填字母![]() 。
。
a.在加入氯化钙溶液后,振荡、静置,向上层清液中继续加入少量氯化钙溶液
b.在加入氯化钙溶液后,振荡、静置,向上层清液中再加入少量碳酸钠溶液
c.在加入氯化钙溶液后,振荡、静置,取上层清液再加入少量碳酸钠溶液
②所得晶体中碳酸氢钠的纯度为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可由天然气为原料制备甲醇,也可由水煤气合成甲醇.
![]() 已知:
已知:![]() ,
,![]() ,
,![]() 。试写出由
。试写出由![]() 和
和![]() 制取甲醇的热化学方程式:______;
制取甲醇的热化学方程式:______;
![]() 通过下列反应制备甲醇:
通过下列反应制备甲醇:![]() ,图甲是反应时
,图甲是反应时![]() 和
和![]() 的浓度随时间t的变化情况,从反应开始到平衡,用
的浓度随时间t的变化情况,从反应开始到平衡,用![]() 表示平均反应速率
表示平均反应速率![]() ______,平衡时CO的转化______.
______,平衡时CO的转化______.
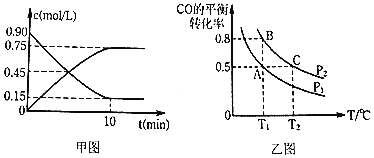
![]() 在一容积可变的密闭容器中充入
在一容积可变的密闭容器中充入![]() 和
和![]() ,CO的平衡转化率随温度
,CO的平衡转化率随温度![]() 、压强
、压强![]() 的变化如图乙所示.
的变化如图乙所示.
![]() 下列说法不能判断该反应达到化学平衡状态的是______
下列说法不能判断该反应达到化学平衡状态的是______![]() 填字母
填字母![]()
A ![]() 的消耗速率等于
的消耗速率等于![]() 的生成速率的2倍
的生成速率的2倍
B ![]() 的体积分数不再改变
的体积分数不再改变
C 体系中![]() 的转化率和CO的转化率相等
的转化率和CO的转化率相等
D 体系中气体的平均摩尔质量不再改变
![]() 比较A、B两点压强大小
比较A、B两点压强大小![]() ______
______![]() 填“
填“![]() 、
、![]() 、
、![]() ”
”![]()
![]() 若达到化学平衡状态A时,容器的体积为20L,如果反应开始时仍充入
若达到化学平衡状态A时,容器的体积为20L,如果反应开始时仍充入![]() 和
和![]() 2,则在平衡状态B时,容器的体积
2,则在平衡状态B时,容器的体积![]() ______L;
______L;
![]() 以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池
以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池![]() 电极材料为惰性电极
电极材料为惰性电极![]()
![]() 若KOH溶液足量,则电池负极反应的离子方程式为______;
若KOH溶液足量,则电池负极反应的离子方程式为______;
![]() 若电解质溶液中KOH的物质的量为
若电解质溶液中KOH的物质的量为![]() ,当有
,当有![]() 甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是______.
甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型高效净水剂PAFC--聚合氯化铁铝![]()
![]() ,
,![]() ,
,![]() 广泛用于生活用水的净化和废水的净化
广泛用于生活用水的净化和废水的净化
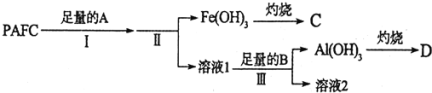
![]() 为测定PAFC中Al的含量,采用如图所示流程进行.
为测定PAFC中Al的含量,采用如图所示流程进行.
回答下列问题:
![]() 有关PAFC的说法正确的是 ______
有关PAFC的说法正确的是 ______
A PAFC中铁显![]() 价
价
B PAFC用于净化饮用水时,可以除去水中所有的有害物质
C PAFC用于净水时,比用相同量的氯化铝和氯化铁对水的pH改变小
D PAFC在强酸性或强碱性溶液中都能稳定存在
![]() 步骤I中的试剂A是 ______
步骤I中的试剂A是 ______ ![]() 填“氨水”或“氢氧化钠溶液”
填“氨水”或“氢氧化钠溶液”![]()
![]() 步骤III的离子方程式为 ______ .
步骤III的离子方程式为 ______ .
![]() 实验室进行“灼烧”时所需的陶瓷仪器有 ______ .
实验室进行“灼烧”时所需的陶瓷仪器有 ______ .
![]() 溶液2中存在的电荷守恒式为 ______ ;向溶液2中滴加少量NaOH镕液,则
溶液2中存在的电荷守恒式为 ______ ;向溶液2中滴加少量NaOH镕液,则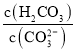 ______填“变大”、“变小”或“不变”
______填“变大”、“变小”或“不变”![]() .
.
![]() 已知C和某一金属在高温下发生反应可用于焊接钢轨,某同学在实验室中进行此反应,反应结束后将所得固体溶于足量的稀硫酸,滴加KSCN溶液无明显现象,由此该同学确定该固体混合物中无
已知C和某一金属在高温下发生反应可用于焊接钢轨,某同学在实验室中进行此反应,反应结束后将所得固体溶于足量的稀硫酸,滴加KSCN溶液无明显现象,由此该同学确定该固体混合物中无![]() ,他的判断是否正确?说明理由.
,他的判断是否正确?说明理由.![]() 可用文字或离子方程式解释理由
可用文字或离子方程式解释理由![]() .______ .
.______ .
![]() 有资料介绍:溶液中铝元素以氢氧化物
有资料介绍:溶液中铝元素以氢氧化物![]() 用
用![]() 表示
表示![]() 形式存在的pH范围是
形式存在的pH范围是![]() 现有A、B两种均含铝元素形成的某种离子溶液,其pH分别为1、13,两溶液等体积混合时反应的离子方程式为 ______ .
现有A、B两种均含铝元素形成的某种离子溶液,其pH分别为1、13,两溶液等体积混合时反应的离子方程式为 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积变化的曲线如图所示。据图判断正确的是 ( )
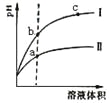
A.Ⅱ为盐酸稀释时pH变化曲线
B.a点Kw的数值比c点Kw的数值大
C.b点溶液的导电性比c点溶液的导电性强
D.b点酸的总浓度大于a点酸的总浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型锂-空气电池具有能量密度高的优点,可以用作新能源汽车的电源,其结构如图所示,其中固体电解质只允许Li+通过。下列说法正确的是
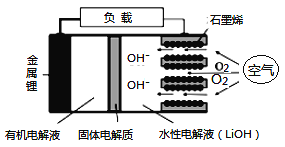
A. Li+穿过固体电解质向正极移动而得到LiOH溶液
B. 放电时,当外电路中有1 mol e-转移时,水性电解液离子总数增加NA
C. 应用该电池电镀铜,阴极质量增加64 g,理论上将消耗11.2 L O2
D. 放电时,负极反应式:Li-e-+OH-=LiOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积恒定的密闭容器中,进行如下可逆反应:A(s)+B(g)![]() 2C(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是( )
2C(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是( )
①混合气体的密度 ②容器内气体的压强 ③混合气体的总物质的量 ④B物质的量浓度
A. ①②④ B. ②③ C. ②③④ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用“KClO3氧化法”制备KIO3的工艺流程如下图所示,其中“酸化反应”所得到的产物有KH(IO3)2、Cl2和KCl。下列叙述错误的是
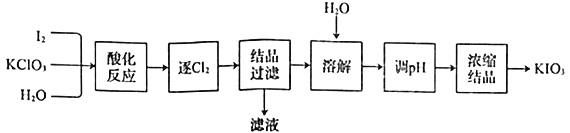
A.KIO3可作为食盐中的补碘剂
B.“逐Cl2”采用的方法通常是加热
C.“滤液”中的溶质主要是KCl
D.“调pH”步骤中所加入的试剂是NaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com