
【题目】一种新型高效净水剂PAFC--聚合氯化铁铝![]()
![]() ,
,![]() ,
,![]() 广泛用于生活用水的净化和废水的净化
广泛用于生活用水的净化和废水的净化
![]() 为测定PAFC中Al的含量,采用如图所示流程进行.
为测定PAFC中Al的含量,采用如图所示流程进行.
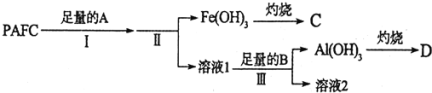
回答下列问题:
![]() 有关PAFC的说法正确的是 ______
有关PAFC的说法正确的是 ______
A PAFC中铁显![]() 价
价
B PAFC用于净化饮用水时,可以除去水中所有的有害物质
C PAFC用于净水时,比用相同量的氯化铝和氯化铁对水的pH改变小
D PAFC在强酸性或强碱性溶液中都能稳定存在
![]() 步骤I中的试剂A是 ______
步骤I中的试剂A是 ______ ![]() 填“氨水”或“氢氧化钠溶液”
填“氨水”或“氢氧化钠溶液”![]()
![]() 步骤III的离子方程式为 ______ .
步骤III的离子方程式为 ______ .
![]() 实验室进行“灼烧”时所需的陶瓷仪器有 ______ .
实验室进行“灼烧”时所需的陶瓷仪器有 ______ .
![]() 溶液2中存在的电荷守恒式为 ______ ;向溶液2中滴加少量NaOH镕液,则
溶液2中存在的电荷守恒式为 ______ ;向溶液2中滴加少量NaOH镕液,则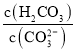 ______填“变大”、“变小”或“不变”
______填“变大”、“变小”或“不变”![]() .
.
![]() 已知C和某一金属在高温下发生反应可用于焊接钢轨,某同学在实验室中进行此反应,反应结束后将所得固体溶于足量的稀硫酸,滴加KSCN溶液无明显现象,由此该同学确定该固体混合物中无
已知C和某一金属在高温下发生反应可用于焊接钢轨,某同学在实验室中进行此反应,反应结束后将所得固体溶于足量的稀硫酸,滴加KSCN溶液无明显现象,由此该同学确定该固体混合物中无![]() ,他的判断是否正确?说明理由.
,他的判断是否正确?说明理由.![]() 可用文字或离子方程式解释理由
可用文字或离子方程式解释理由![]() .______ .
.______ .
![]() 有资料介绍:溶液中铝元素以氢氧化物
有资料介绍:溶液中铝元素以氢氧化物![]() 用
用![]() 表示
表示![]() 形式存在的pH范围是
形式存在的pH范围是![]() 现有A、B两种均含铝元素形成的某种离子溶液,其pH分别为1、13,两溶液等体积混合时反应的离子方程式为 ______ .
现有A、B两种均含铝元素形成的某种离子溶液,其pH分别为1、13,两溶液等体积混合时反应的离子方程式为 ______ .
【答案】C 氢氧化钠溶液 ![]() 瓷坩埚、泥三角、酒精灯
瓷坩埚、泥三角、酒精灯 ![]() 变小 否,
变小 否,![]()
![]()
【解析】
(1)为检测PAFC中Al和Fe含量,PAFC加入足量A为NaOH溶液,反应生成Fe(OH)3沉淀和NaAlO2溶液、NaCl溶液;过滤后得到Fe(OH)3灼烧得到C为Fe2O3,滤液Ⅰ中通入过量的B为CO2气体,和NaAlO2溶液反应生成Al(OH)3沉淀,过滤得到Al(OH)3沉淀,灼烧得到D为Al2O3;
①A、阴离子总价态:6-n+n=6,铝只有+3价,所以Fe就是6-3=3,外面的m只是表示这样一个分子聚合度,与价态无关,A错误;
B、净化饮用水时可看做FeCl3、AlCl3水解生成的Fe(OH)3胶体、Al(OH)3胶体,具有吸附悬浮杂质的作用,但不能消毒杀菌,B错误;
C、PAFC用于净水时,OH-的存在对水的电离起到抑制作用,比用相同量的AlCl3和FeCl3对水的pH改变小,C正确;
D、PAFC是碱式复盐,在强酸性和强碱性溶液中都不能稳定存在,D错误;
故选C;
②步骤Ⅰ中的试剂A为氢氧化钠溶液;
③步骤Ⅲ的反应为NaAlO2溶液中通入过量CO2气体生成Al(OH)3沉淀,反应的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
④实验室进行“灼烧”是灼烧Al(OH)3固体,固体灼烧所需陶瓷仪器为坩埚、泥三角、酒精灯;
⑤溶液2为NaHCO3溶液和NaCl溶液,溶液中阴阳离子所带电荷数相同,溶液中存在电荷守恒为:c(H+)+c(Na+)=c(OH-)+c(HCO3-)+2c(CO32-)+c(Cl-),向溶液2中滴加少量NaOH溶液和NaHCO3反应生成Na2CO3和H2O,c(CO32-)增大,c(H2CO3)减小,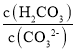 比值减小;
比值减小;
(2)铝热反应所得的固体混合物,将其溶于足量H2SO4,滴加KSCN溶液无明显现象,说明无Fe3+,但不能说明固体中不含Fe2O3,因为铝热反应生成铁可以还原Fe3+为Fe2+,离子方程式为:Fe2O3+6H+=2Fe3++3H2O,Fe+2Fe3+=3Fe2+,反应结束后将所得固体溶于足量的稀H2SO4,滴加KSCN溶液无明显现象,不能确定该固体混合物中无Fe2O3;
(3)A、B两种均含铝元素形成的某种离子溶液,其pH分别为1、13,说明溶液呈酸性是因为Al3+水解,溶液呈碱性为NaAlO2溶液水解显碱性;混合后水解相互促进反应生成Al(OH)3沉淀;反应的离子方程式为:Al3++3AlO2-+6H2O=4Al(OH)3↓。


 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】高纯碳酸锰在电子工业中有着重要的应用,湿法浸出软锰矿(主要成分为MnO2,含有少量Fe、Al、Mg等杂质元素)制备高纯碳酸锰的流程如下:其中除杂过程包括:①向浸出液中加入一定量的试剂X,调节浸出液的pH为3.5~5.5;②再加入一定量的软锰矿和双氧水,过滤;③…下列说法正确的是(已知室温下:Kap[Mg(OH)2]=1.8×10-11,Kap[Al(OH)3]=3.0×10-34,Kap[Fe(OH)3]=4.0×10-38。)
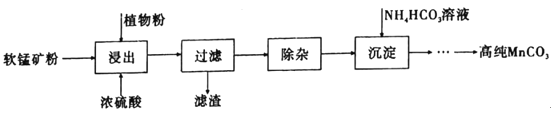
A.浸出时加入植物粉的作用是作为还原剂
B.除杂过程中调节浸出液的pH为3.5~5.5可完全除去Fe、Al、Mg等杂质
C.试剂X可以是MnO、MnO2、MnCO3等物质
D.为提高沉淀MnCO3步骤的速率可以持续升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.侯氏制碱法的工艺过程中主要应用了物质熔沸点的差异
B.可用蘸有浓氨水的玻璃棒检验输送氯气的管道是否漏气
C.白炽灯工作时,电能全部转化为光能
D.日本福岛核电站核泄漏事故提醒我们不要开发新能源,要大力挖掘化石能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3.48gFe3O4完全溶解在100mL 1mol·L-1H2SO4溶液中,然后加入K2Cr2O7溶液25mL,恰好使溶液中的Fe2+全部反应完,Cr2O72-全部转化为Cr3+,则K2Cr2O7溶液的物质的量浓度为
A.0.033mol·L—1B.0.3mol·L—1C.0.2mol·L—1D.0.1mol·L—1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、X、Y、Z、W六种短周期主族元素,A是地壳中含量最多的金属元素,短周期主族元素中B的原子半径最大,X、Y、Z、W元素在周期表中的相对位置如图所示,其中Z元素原子最外层电子数是电子层数的2倍。请回答下列问题:
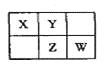
(1)W的最高价氧化物化学式是________________;Z的原子结构示意图为______。
(2)A、B各自最高价氧化物对应的水化物反应的化学方程式为_____________。
(3) AW3可用于净水,其原理是_____________。(请用离子方程式表示)
(4)工业合成X的简单气态氢化物是放热反应。下列措施中既能提高反应速率,又能提高原料转化率的是__________________。
a.升高温度
b.加入催化剂
c.将X的简单气态氢化物及时移离
d.增大反应体系的压强
(5)标准状况下,2.24L X的简单气态氢化物被100 mL l mol L-1X的最高价氧化物对应的水化物溶液吸收后,所得溶液中离子浓度从大到小的顺序是(用离子符号表示)_______________________________。
(6)WY2在杀菌消毒的同时,可将剧毒氰化物氧化成两种无毒气体而除去,写出用WY2(沸点9.9℃)氧化除去CN-的离子方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三个容器中最初存在的物质及数量如图所示,三个容器最初的容积相等,温度相同,反应中甲、丙的容积不变,乙中的压强不变,在一定温度下反应达到平衡。下列说法正确的是
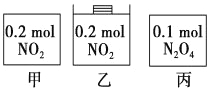
A. 平衡时各容器内c(NO2)的大小顺序为乙>甲>丙
B. 平衡时N2O4的百分含量:乙>甲=丙
C. 平衡时甲中NO2与丙中N2O4的转化率相同
D. 平衡时混合物的平均相对分子质量:甲>乙>丙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中含有CO、NOx等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。
(1)已知 4CO(g)+2NO2(g)![]() 4CO2(g)+N2(g) ΔH=-1200 kJ·mol1
4CO2(g)+N2(g) ΔH=-1200 kJ·mol1
①该反应在________________(填“高温、低温或任何温度”)下能自发进行。
②对于该反应,改变某一反应条件(温度T1>T2),下列图象正确的是_______(填序号)。
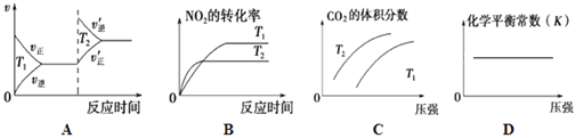
③某实验小组模拟上述净化过程,一定温度下,在2L的恒容密闭容器中,起始时按照甲、乙两种方式进行投料,经过一段时间后达到平衡状态,测得甲中CO的转化率为50%,则该反应的平衡常数为__________;两种方式达平衡时,N2的体积分数:甲______乙( 填“>、=、<或不确定”,下同),NO2的浓度:甲______乙。

(2)柴油汽车尾气中的碳烟(C)和NOx可通过某含钴催化剂催化消除。不同温度下,将模拟尾气(成分如下表所示)以相同的流速通过该催化剂测得所有产物(CO2、N2、N2O)与NO的相关数据结果如图所示。
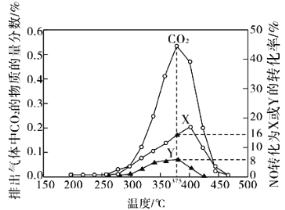
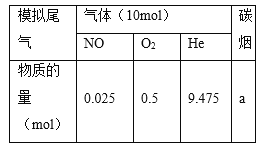
①375℃时,测得排出的气体中含0.45 mol O2和0.0525 mol CO2,则Y的化学式为________。
②实验过程中采用NO模拟NOx,而不采用NO2的原因是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com