
【题目】常温下,一定体积![]() 的二元弱酸
的二元弱酸![]() 溶液与一定体积
溶液与一定体积![]() 的NaOH溶液混合后,溶液呈中性.下列判断正确的是
的NaOH溶液混合后,溶液呈中性.下列判断正确的是![]()
A.溶液中![]()
B.溶液中![]()
C.溶液中![]()
D.溶液中![]()
【答案】D
【解析】
常温下,pH=3的二元弱酸H2R溶液中H2R的浓度大于0.001mol/L,pH=11的NaOH溶液中NaOH浓度为0.001mol/L,二者混合溶液呈中性,则c(H+)=c(OH-),
A、二者混合后溶液体积大于氢氧化钠溶液体积,所以混合溶液中c(Na+)<10-3mol/L,A错误;
B.二者混合溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得:c(Na+)+c(H+)=c(OH-)+2c(R2-)+c(HR-),所以得c(Na+)=2c(R2-)+c(HR-),则c(R2-)<c(Na+),B错误;
C.溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+2c(R2-)+c(HR-),C错误;
D.根据电荷守恒得:c(Na+)+c(H+)=c(OH-)+2c(R2-)+c(HR-),所以得c(Na+)=2c(R2-)+c(HR-),D正确;
故选D。


科目:高中化学 来源: 题型:
【题目】铝热反应是铝的一个重要性质,该性质用途十分广泛。 “铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中”。已知:Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如下:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2 054 | 1 535 | 1 462 |
沸点/℃ | 2 467 | 2 980 | 2 750 | - |
I.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?________(填“合理”或“不合理”)。
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是________,反应的离子方程式为______________________________________。
(3)实验室溶解该熔融物,在下列试剂中最适宜的试剂是________(填序号)。
A、浓硫酸 B、稀硫酸 C、稀硝酸 D、氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入6mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
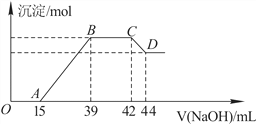
(1)依题意,请写出熔融物中铁与该稀的硝酸反应的离子方程式:____________________
(2)图中OA段没有沉淀生成,此阶段发生反应的离子方程式为__________________。
(3)在BC段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为_____________;
(4)熔融物中铝元素的物质的量为________mol。
(5)B点对应的沉淀的物质的量为______mol,A点对应的氢氧化钠溶液的体积为________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向0.1mol·L1二元弱酸H2A的溶液中逐滴加入NaOH溶液,H2A、HA-、A2的物质的量分数随pH的变化如图所示。下列叙述正确的是( )
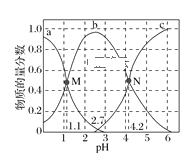
A.a曲线代表HA的物质的量分数随pH的变化
B.M点pH=1.1时,溶液中微粒浓度关系为c(H+)>c(HA)=c(H2A)
C.pH=2.7时,c(A2)+c(HA)+c(H2A)=0.1mol·L1
D.N点pH=4.2时,c(A2)=c(HA),溶液中不存在H2A分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是( )
A.乙二酸与乙二醇在浓硫酸的作用下可以发生酯化反应生成八元环酯
B.新制备的氢氧化铜悬浊液可以鉴别 乙醇、乙酸、乙醛
C.乙炔、乙苯、聚乙烯、乙醇、乙醛都能使酸性KMnO4褪色
D.取某卤代烃少许与氢氧化钠溶液共热,然后加硝酸银溶液,看是否有白色沉淀可以验证某卤代烃中是否含有氯元素。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是![]()
A.![]() 相等的
相等的![]() 溶液、
溶液、![]() 溶液和
溶液和![]() 溶液中,溶质浓度大小关系是:
溶液中,溶质浓度大小关系是:![]()
B.![]() 的
的![]() 溶液加水稀释,溶液中
溶液加水稀释,溶液中![]() 减小
减小
C.![]() 溶液与等体积
溶液与等体积![]() 溶液混合后,溶液的
溶液混合后,溶液的![]()
D.![]() 的
的![]() 溶液中
溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液X中可能含有K+、Mg2+、Al3+、AlO、SiO、CO、SO、SO中的若干种离子。某同学对该溶液进行了如下实验:

下列判断正确的是( )
A. 气体甲一定是纯净物 B. 沉淀甲是硅酸和硅酸镁的混合物
C. K+、AlO和SiO一定存在于溶液X中 D. CO和SO一定不存在于溶液X中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型高效净水剂PAFC--聚合氯化铁铝![]()
![]() ,
,![]() ,
,![]() 广泛用于生活用水的净化和废水的净化
广泛用于生活用水的净化和废水的净化
![]() 为测定PAFC中Al的含量,采用如图所示流程进行.
为测定PAFC中Al的含量,采用如图所示流程进行.
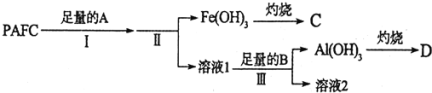
回答下列问题:
![]() 有关PAFC的说法正确的是 ______
有关PAFC的说法正确的是 ______
A PAFC中铁显![]() 价
价
B PAFC用于净化饮用水时,可以除去水中所有的有害物质
C PAFC用于净水时,比用相同量的氯化铝和氯化铁对水的pH改变小
D PAFC在强酸性或强碱性溶液中都能稳定存在
![]() 步骤I中的试剂A是 ______
步骤I中的试剂A是 ______ ![]() 填“氨水”或“氢氧化钠溶液”
填“氨水”或“氢氧化钠溶液”![]()
![]() 步骤III的离子方程式为 ______ .
步骤III的离子方程式为 ______ .
![]() 实验室进行“灼烧”时所需的陶瓷仪器有 ______ .
实验室进行“灼烧”时所需的陶瓷仪器有 ______ .
![]() 溶液2中存在的电荷守恒式为 ______ ;向溶液2中滴加少量NaOH镕液,则
溶液2中存在的电荷守恒式为 ______ ;向溶液2中滴加少量NaOH镕液,则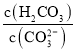 ______填“变大”、“变小”或“不变”
______填“变大”、“变小”或“不变”![]() .
.
![]() 已知C和某一金属在高温下发生反应可用于焊接钢轨,某同学在实验室中进行此反应,反应结束后将所得固体溶于足量的稀硫酸,滴加KSCN溶液无明显现象,由此该同学确定该固体混合物中无
已知C和某一金属在高温下发生反应可用于焊接钢轨,某同学在实验室中进行此反应,反应结束后将所得固体溶于足量的稀硫酸,滴加KSCN溶液无明显现象,由此该同学确定该固体混合物中无![]() ,他的判断是否正确?说明理由.
,他的判断是否正确?说明理由.![]() 可用文字或离子方程式解释理由
可用文字或离子方程式解释理由![]() .______ .
.______ .
![]() 有资料介绍:溶液中铝元素以氢氧化物
有资料介绍:溶液中铝元素以氢氧化物![]() 用
用![]() 表示
表示![]() 形式存在的pH范围是
形式存在的pH范围是![]() 现有A、B两种均含铝元素形成的某种离子溶液,其pH分别为1、13,两溶液等体积混合时反应的离子方程式为 ______ .
现有A、B两种均含铝元素形成的某种离子溶液,其pH分别为1、13,两溶液等体积混合时反应的离子方程式为 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物分子的结构简式如图所示,下列相关叙述正确的是( )

A.该有机化合物含有3种官能团
B.该有机物分子中最多有12个碳原子在同一平面内
C.该有机物分子中最多有6个碳原子共线
D.该有机物分子中最多有14个碳原子在同一平面内
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com