
【题目】铝热反应是铝的一个重要性质,该性质用途十分广泛。 “铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中”。已知:Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如下:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2 054 | 1 535 | 1 462 |
沸点/℃ | 2 467 | 2 980 | 2 750 | - |
I.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?________(填“合理”或“不合理”)。
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是________,反应的离子方程式为______________________________________。
(3)实验室溶解该熔融物,在下列试剂中最适宜的试剂是________(填序号)。
A、浓硫酸 B、稀硫酸 C、稀硝酸 D、氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入6mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
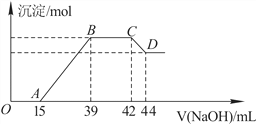
(1)依题意,请写出熔融物中铁与该稀的硝酸反应的离子方程式:____________________
(2)图中OA段没有沉淀生成,此阶段发生反应的离子方程式为__________________。
(3)在BC段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为_____________;
(4)熔融物中铝元素的物质的量为________mol。
(5)B点对应的沉淀的物质的量为______mol,A点对应的氢氧化钠溶液的体积为________mL。
【答案】合理 NaOH溶液 2Al+2OH-+2H2O===2AlO![]() +3H2↑ B 8Fe + 30H++ 3NO3-===8 Fe 3+ + 3NH4+ + 9 H2O H++OH-===H2O NH
+3H2↑ B 8Fe + 30H++ 3NO3-===8 Fe 3+ + 3NH4+ + 9 H2O H++OH-===H2O NH![]() +OH-===NH3·H2O 0.012 0.048 15
+OH-===NH3·H2O 0.012 0.048 15
【解析】
试题本题考查铁铝及其化合物的性质、化学图像分析和化学计算。I.根据铝热反应的原理、铁铝的性质和题给信息作答。
Ⅱ.理清反应过程,分析图像中的每一段对应的反应,结合题给数据利用守恒思想作答。
解答:I.(1)铝热反应的原理为:2Al+Fe2O3![]() Al2O3+2Fe,反应过程中生成铁单质,铝粉可能有剩余,结合题给熔点数据和信息:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金,合理。
Al2O3+2Fe,反应过程中生成铁单质,铝粉可能有剩余,结合题给熔点数据和信息:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金,合理。
(2)铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,铁与氢氧化钠溶液不反应。证明上述所得的块状熔融物中含有金属铝的实验方案为取少量熔融物于试管中,向其中滴加氢氧化钠溶液,看固体是否部分溶解,是否有气体生成。该实验所用试剂是NaOH溶液,反应的离子方程式为2Al+2OH-+2H2O===2AlO![]() +3H2↑ 。
+3H2↑ 。
(3)A、常温下,浓硫酸能使铁、铝钝化,错误;B、铁铝均与稀硫酸反应,生成的氢气对环境无污染,正确;C、稀硝酸 与铁、铝反应有有毒气体NO生成,错误; D、氢氧化钠溶液与铁不反应,错误。选B。
Ⅱ.(1)分析图像知OA段没有沉淀生成,说明硝酸过量,则熔融物中的铁与稀硝酸反应生成硝酸铁,反应过程中无气体生成,则硝酸的还原产物为硝酸铵,利用化合价升降法结合原子守恒、电荷守恒配平,该反应的离子方程式为8Fe + 30H++ 3NO3-===8 Fe 3+ + 3NH4+ + 9 H2O;
(2)OA段发生酸碱中和反应,离子方程式为H++OH-===H2O ;
(3)BC段沉淀的量没有发生变化,NH4NO3和NaOH反应生成硝酸钠和一水合氨,反应的离子方程式为NH4++OH-===NH3·H2O ;
(4)由图可知,CD段消耗的氢氧化钠溶液的体积为44mL-42mL=2mL,故参加反应的氢氧化钠为0.002L×6mol/L=0.012mol,根据Al(OH)3+OH-=AlO2-+2H2O可知,Al(OH)3的物质的量为0.012mol,根据铝元素守恒知熔融物中铝元素的物质的量为0.012mol。
(5)AB段发生的反应为Fe3++3OH-=Fe(OH)3↓,Al3++3OH-=Al(OH)3↓,消耗氢氧化钠的物质的量为(39-15)×10-3L×6mol/L=0.144mol,Al3+的物质的量为0.012mol,消耗氢氧化钠的物质的量为0.036mol,则与Fe3+反应的氢氧化钠的物质的量为0.144-0.036=0.108mol,Fe3+的物质的量为0.036mol,B点铝离子和铁离子恰好完全生成沉淀,根据元素守恒知生成沉淀的物质的量为0.048mol。由图像知A点对应的氢氧化钠溶液的体积为15mL。


科目:高中化学 来源: 题型:
【题目】室温下,将![]()
![]() 固体溶于水配成100mL溶液,向溶液中加入下列物质,有关结论正确的是( )
固体溶于水配成100mL溶液,向溶液中加入下列物质,有关结论正确的是( )
加入的物质 | 结论 | |
A |
| 反应结束后, |
B |
| 溶液中 |
C |
| 由水电离出的 |
D |
| 反应完全后,溶液pH减小, |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将CO2通入2LpH=12的KOH溶液中,溶液中水电离的OH-离子浓度(φ)与通入的CO2的体积(V)的关系如下图所示。下列叙述不正确的是

A.a点溶液中:水电离出的c(H+)=1×10-12mol/L
B.b点溶液中:c(H+)=1×10-7mol/L
C.c点溶液中:c(K+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
D.d点溶液中:c(K+)=2c(CO32-)+c(HCO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨在化肥生产、贮氢及燃煤烟气脱硫脱硝等领域用途非常广泛。
(1)尿素[CO(NH2)2]与氰酸铵(NH4CNO)互为___________;(选填:“同一物质”或“同系物”或“同分异构体”)氰酸铵属于_______化合物(选填:“离子”或“共价”)。
(2)液氨是一种贮氢材料,已知:断开1mol共价键吸收的能量数据如表
共价键 | H—H | N—H | N≡N |
kJ·mol-1 | 436 | 390.8 | 946 |
则合成氨反应:N2(g) + 3H2 (g)= 2NH3(g) ,生成2mol氨气放出 _________kJ热量,若1molN2与3molH2在一定条件下反应,达到平衡时放出36.32kJ热量,则此时NH3所占的体积分数为______ 。如图装置通直流电,液氨可电解释放氢气,该过程中能量转化方式为由电能转化为_____能。

(3)氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g) + 4NH3(g) ![]() 5N2(g) +6H2O(g)。
5N2(g) +6H2O(g)。
①能说明该反应已达到平衡状态的标志是_______(不定项选择)。
a.反应速率4v ( NH3) =5v ( N2)
b.容器内压强不再随时间而发生变化
c.容器内N2的物质的量分数不再随时间而发生变化
d.容器内n(NO)∶n(NH3)∶n(N2)∶n(H2O) = 6∶4∶5∶6
②某次实验中测得容器内NO及N2的物质的量随时间变化如图所示,图中v (正)与v (逆)相等的点为_________(选填字母)。
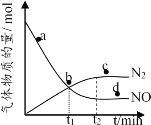
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠晶体(Na2S2O3·5H2O,M=248 g·mol1)可用作定影剂、还原剂。回答下列问题:
(1)已知:Ksp(BaSO4)=1.1×1010,Ksp(BaS2O3)=4.1×105。市售硫代硫酸钠中常含有硫酸根杂质,选用下列试剂设计实验方案进行检验:
试剂:稀盐酸、稀H2SO4、BaCl2溶液、Na2CO3溶液、H2O2溶液
完成下列表格
实验步骤 | 现象 |
①取少量样品,加入除氧蒸馏水 | ②固体完全溶解得无色澄清溶液 |
③加入过量稀盐酸 | ④___________,有刺激性气体产生 |
⑤静置,(吸)取上层清液,滴入BaCl2溶液 | ⑥_______________________________ |
(2)利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①溶液配制:称取1.2000 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在烧杯中溶解,完全溶解后,全部转移至100 mL的_________中,加蒸馏水至刻线。
②滴定:用___________________取0.00950 mol·L1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量KI,发生反应: Cr2O72—+6I+14H+=3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32—=S4O62—+2I。加入淀粉溶液作为指示剂,继续滴定,当溶液_____________________,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为_________%(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是最早记载丹砂的药用价值和炼制方法的,为了使人民重视丹砂,我国曾发行面值为10分的丹砂邮票。汞单质及其化合物在工业生产和科学研究上有着广泛用途。丹砂炼汞的反应原理包括以下两个反应:
反应I:HgS+O2![]() Hg+SO2
Hg+SO2
反应II:4HgS+4CaO![]() 4Hg+3CaS+CaSO4
4Hg+3CaS+CaSO4
(1)反应I中,还原产物是______,每生成1个SO2分子,转移电子数为______。
(2)反应II中,HgS是________(填“氧化剂”、“还原剂”或“氧化剂和还原剂”),用双线桥法标出反应II中电子转移的方向和数目。________
4HgS+4CaO![]() 4Hg+3CaS+CaSO4
4Hg+3CaS+CaSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列说法正确的是![]()
A.![]() 的
的![]() 溶液或醋酸中,由水电离出的
溶液或醋酸中,由水电离出的![]() 均为
均为![]()
B.![]() 的醋酸和
的醋酸和![]() 的NaOH溶液等体积混合后,
的NaOH溶液等体积混合后,![]()
C.同体积同pH的氢氧化钠溶液和氨水分别稀释相同倍数,氨水的pH较大
D.![]()
![]() 溶液和
溶液和![]()
![]() 溶液等体积混合,溶液中
溶液等体积混合,溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯碳酸锰在电子工业中有着重要的应用,湿法浸出软锰矿(主要成分为MnO2,含有少量Fe、Al、Mg等杂质元素)制备高纯碳酸锰的流程如下:其中除杂过程包括:①向浸出液中加入一定量的试剂X,调节浸出液的pH为3.5~5.5;②再加入一定量的软锰矿和双氧水,过滤;③…下列说法正确的是(已知室温下:Kap[Mg(OH)2]=1.8×10-11,Kap[Al(OH)3]=3.0×10-34,Kap[Fe(OH)3]=4.0×10-38。)
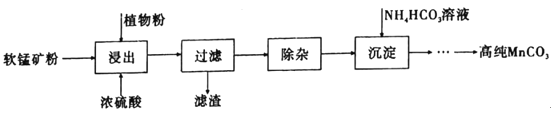
A.浸出时加入植物粉的作用是作为还原剂
B.除杂过程中调节浸出液的pH为3.5~5.5可完全除去Fe、Al、Mg等杂质
C.试剂X可以是MnO、MnO2、MnCO3等物质
D.为提高沉淀MnCO3步骤的速率可以持续升高温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com