
【题目】将少量V2O5 及一定量Ag2SO4 固体置于恒容真空密闭容器,在一定温度下发生反应: Ag2SO4(s)![]() Ag2O(s) + SO3(g) 2SO3(g)
Ag2O(s) + SO3(g) 2SO3(g)![]() 2SO2(g) + O2(g),10min 后反应达平衡,此时c(SO3)=0.4mol/L,c(SO2)=0.1mol/L。下列说法中,不正确的是
2SO2(g) + O2(g),10min 后反应达平衡,此时c(SO3)=0.4mol/L,c(SO2)=0.1mol/L。下列说法中,不正确的是
A. 平衡时,容器内气体密度为40g/L。
B. 10min 内氧气的平均反应速率为0.005mol·(L·min)-1
C. 再加入少量AgSO4 固体,则反应均向正反应方向移动
D. 该温度下,2Ag2SO4(s)![]() 2Ag2O(s) +2SO2(g) +O2(g)的平衡常数为5×10-4
2Ag2O(s) +2SO2(g) +O2(g)的平衡常数为5×10-4
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】某化学研究小组探究外界条件对化学反应mA(g)+nB(g)![]() pC(g)的速率和平衡的影响图像如下,下列判断正确的是
pC(g)的速率和平衡的影响图像如下,下列判断正确的是
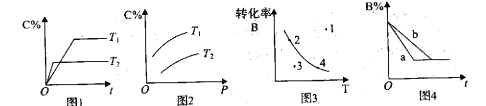
A. 由图1可知,T1<T2,该反应正反应为吸热反应
B. 由图2可知,该反应m+n<p
C. 图3中,点3的反应速率V正>V逆
D. 图4中,若m+n=p,则a曲线一定使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其氧化物是日常生活生产中应用广泛的材料,请回答下列问题:
(1)基态铁原子的价电子排布式为_________。
(2)Fe3+、Co3+与N3+、CN-等可形成络合离子。
①C、N、O中第一电离能最大的为________,其原因是_____________________。
②K3[Fe(CN)6]可用于检验Fe2+,1mol K3[Fe(CN)6]中含有σ键的数目为________________。
(3)铁的另一种配合物Fe(CO)x的中心原子价电子数与配体提供的电子数之和为18,则x=_____。已
知该配合物的熔点为-20.5 ℃,沸点为103℃,易溶于CCl4,据此可以判断Fe(CO)x晶体属于_____________(填晶体类型)。
(4)金属铁晶体中原子采用_________堆积,铁晶体的空间利用率为______(用含π的式子表示)。
(5)某种离子型铁的氧化物晶胞如图所示,它由A、B 方块组成。则该化合物中Fe2+、Fe3+、O2-的个数比为_______________(填最简整数比);已知该晶体的密度为d g·cm-3,阿伏加德罗常数的值为NA,则晶胞参数a为_______________nm(用含d和NA的代数式表示)。
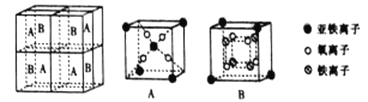
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1.000mol/L 盐酸滴入20.00mL1.000 mol/L 氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示。
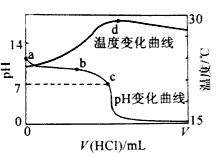
下列有关说法不正确的是( )
A. a 点由水电离出的c(H+)>1.0×10-14mol/L
B. b 点: c(NH4+)>c(Cl-)
C. c 点: c(Cl-)=c(NH4+)
D. d 点后,溶液温度略下降的主要原因是NH3·H2O 电离吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)以下列出的是一些原子的2p能级和3d能级中电子排布的情况。试判断,违反了泡利原理的是___,违反了洪特规则的是___。
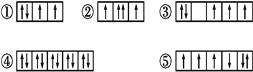
(2)某元素的激发态(不稳定状态)原子的电子排布式为1s22s22p63s13p33d2,则该元素基态原子的电子排布式为___;其最高价氧化物对应水化物的化学式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.双氧水(主要成分H2O2)是常见的氧化剂、还原剂。
(1)如下图是工业上制备过氧化氢最常见的方法,写出实际发生反应的总方程式____________。

(2)H2O2可看作二元弱酸,写出它在水中第一步电离的方程式______________________________。
II.A、B、C、D、E、X是中学常见的无机物,存在如下图转化关系(部分生成物和反应条件略去)。

(1)若A为常见的金属单质,焰色反应呈黄色,X能使品红溶液褪色,写出C和E反应的离子方程式:__________________________________________________________________________________。
(2)若A为短周期元素组成的单质,该元素的最高价氧化物的水化物酸性最强,则X可能为______________________(填代号)。
a.NaHCO3 b.Na2CO3 c.Fe(OH)3 d.Na[Al(OH)4]
(3)若A为淡黄色粉末,则A的电子式为____________________。若X为一种最常见的造成温室效应的气体。则鉴别等浓度的D、E两种溶液,可选择的试剂为__________(填代号)。
a.盐酸 b.BaCl2溶液 c.NaOH溶液 d.Ca(OH)2溶液
(4)若A为氧化物,X是Fe,溶液D中加入KSCN溶液变红。则A与H2O反应的化学反应方程式为________________________________,E是__________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,lmolX与3molY在恒容密闭容器中发生反应X(g)+3Y(g)![]() 2Z(g),△H = -QkJ·mol-1(Q>0),下列说法正确的是( )
2Z(g),△H = -QkJ·mol-1(Q>0),下列说法正确的是( )
A. 达到平衡时,3v正(Y)=2v逆(Z)
B. 反应一段时间后,X与Y的转化率之比为1:3
C. X的体积分数不变,说明反应己达到平衡状态
D. 达到平衡后,若从平衡体系中移走部分的Z则v正增大v逆减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼酸(H2BO3)可以通过电解NaB(OH)4溶液的方法制备,工作原理如图所示。下列有关表述错误的是( )
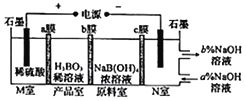
A. M室的电极反应式为2H2O-4e-=O2↑+4H+
B. N室中,进口和出口的溶液浓度大小关系为a%<b%
C. b膜为阴离子交换膜,产品室发生反应为H++[B(OH)4]-=H3BO3+H2O
D. 理论上每生成1molH3BO3,阴极室可生成5.6L气体(标准状况)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com