
在如图所示的三个容积相同的容器①②③中进行如下反应:3A(g)+B(g)  2C(g) ΔH<0,若起始温度相同,分别向三个容器中通入3 mol A和1 mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为 ( )
2C(g) ΔH<0,若起始温度相同,分别向三个容器中通入3 mol A和1 mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为 ( )

A.③②① B.③①② C.①②③ D.②①③
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
美国一个海军航空站安装了一台250 kW的MCFC型燃料电池。该电池可同时供应电和蒸汽,其燃料为H2,电解质为熔融的K2CO3,工作温度为600~800 ℃。已知该电池的总反应为2H2+O2 2H2O,负极反应为H2+CO32--2e-
2H2O,负极反应为H2+CO32--2e- H2O+CO2。下列推断正确的是
H2O+CO2。下列推断正确的是
A.正极反应为4OH--4e- O2↑+2H2O B.放电时, CO32-向负极移动
O2↑+2H2O B.放电时, CO32-向负极移动
C.电池供应1 mol水蒸气,转移的电子的物质的量为4 mol D.放电时CO32-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
在Na2SO4、NaCl、NaOH的混合溶液中,含有Na+、SO42-、OH-的个数比是8:1:2,则溶液中Na2SO4、NaCl、NaOH的物质的量之比是( )
A.1:1:1 B.1:4:2 C.1:2:4 D.1:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室需要0.1 mol/L NaOH溶液450 mL和0.5 mol/L硫酸溶液450 mL.根据这两种溶液的配制情况回答下列问题:

(1) 根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为 ____ mL(计算结果保留一位小数,下同)。
(2)如图所示的仪器中配制溶液肯定不需要的是 (填序号),仪器C的名称是 ,本实验所需玻璃仪器E的名称为
(3)在配制NaOH溶液实验中,其他操作均正确。若定容时仰视刻度线,则所配制溶液浓度 ______0.1 mol/L(填“大于”“等于”或“小于”,下同)。若NaOH溶液未冷却即转移至容量瓶定容,则所配制溶液浓度__ 0.1 mol/L。
(4) 下列操作不正确的是 (填序号)。[]
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配液润洗
C.将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶中
D.将准确量取的18.4 mol·L-1的硫酸,注入已盛有30 mL水的100 mL的容量瓶中,加水至刻度线
E.定容时不小心水加多了少许,立即用胶头滴管吸出即可
 F.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
F.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
(5)右图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
①将________升氯化氢(标准状况)通入1.00L水中可得到36.5﹪的浓盐酸,该浓盐酸中HCl的物质的量浓度为
②取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是 。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
A.ΔH<0、ΔS>0的反应在任何温度下都能自发进行
B.NH4HCO3(s) NH3 (g)+H2O(g)+CO2(g) ΔH=+185.57 kJ·mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向
NH3 (g)+H2O(g)+CO2(g) ΔH=+185.57 kJ·mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向
C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据
D.在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的速率
查看答案和解析>>
科目:高中化学 来源: 题型:
CO是对环境影响较大的气体,对它的合理控制和治理是优化我们生存环境的有效途径。
(1)工业上用CO和H2做原料可以合成甲醇,作为液体燃料。已知:
① 2H2(g)+CO(g)+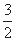 O2(g) = 2H2O(g)+CO2(g) ΔH1= -594.1kJ/mol
O2(g) = 2H2O(g)+CO2(g) ΔH1= -594.1kJ/mol
② 2CH3OH(l)+3O2(g) = 4H2O(g)+2CO2(g) ΔH2 = -1452kJ/mol
请写出用CO(g)和H2(g)合成1mol液态甲醇的热化学反应方程式:___________。
(2)一定温度下,在容积为2L的恒容容器中加入3mol H2和2mol CO,当反应2H2(g)+CO(g)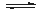 CH3OH(g)达到平衡时,测得容器内的压强是反应前压强的
CH3OH(g)达到平衡时,测得容器内的压强是反应前压强的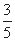 ,据此计算该温度下反应的平衡常数(写过程)。
,据此计算该温度下反应的平衡常数(写过程)。
(3)在恒温恒容的条件下,向(2)达到平衡的容器中再通入CO(g)和CH3OH(g),使得CO(g)和CH3OH(g)浓度均为原平衡的2倍,则平衡 。
A.向正反应方向移动 B.向逆反应方向移动
C.不移动 D.无法判断是否移动
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列热化学方程式: ( )
2H2(g)+O2(g)===2H2O(g);ΔH=-483.6 kJ/mol
H2(g)+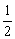 O2(g)===H2O(g);ΔH=-241.8 kJ/mol
O2(g)===H2O(g);ΔH=-241.8 kJ/mol
H2(g)+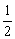 O2(g)===H2O(l);ΔH=-285.8 kJ/mol 则氢气的燃烧热为
O2(g)===H2O(l);ΔH=-285.8 kJ/mol 则氢气的燃烧热为
A.438.6 kJ/mol B.241.8 kJ/mol C.285.8 kJ/mol D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
在1 000 K时,已知反应Ni(s)+H2O(g) 
 NiO(s)+H2(g)的平衡常数
NiO(s)+H2(g)的平衡常数
K=0.005 9。当水蒸气和氢气的物质的量浓度相等时,此反应( )
A.已达平衡状态 B.未达平衡状态,反应正向进行
C.未达平衡状态,反应逆向进行 D.无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com