
����Ŀ�����ɽ��������������е�Ӧ��ʮ�ֹ㷺��
��.CrԪ���γɵ��Ȼ�����(CrO2Cl2)����Ҫ��;�����л��ϳ��п������������Ȼ��������������л��ﷴӦ��
(1)CrO2Cl2������Ϊ���ɫҺ�壬����CCl4��CS2�Ȼ��ܣ�������ʵ����ʵ�����ж�CrO2Cl2������_____________(���������������Ǽ�����)���ӣ��÷��ӵ����幹�͵�����Ϊ___________��
��.Cu���γɶ�����������������Ϣ�ش����⣺
(2)��ʢ������ͭˮ��Һ���Թ�����μ��백ˮ�����ȳ�����ɫ�����������μӰ�ˮ����ɫ�����ܽ⣬�õ�����ɫ������Һ���Ⱥ��������ӷ���ʽΪCu2++2NH3.H2O=Cu(OH)2��+2NH4+��_______________��
(3)��������ɫ����Һ�����Ҵ�����������ɫ�ľ��塣����ɫ����Ļ�ѧʽΪ__________________________�����������ԭ����_______________________________________________________������Cu���ʵķ�ĩ����NH3��Ũ��Һ�У�ͨ��O2����ַ�Ӧ����Һ������ɫ���÷�Ӧ�����ӷ���ʽ��____________________��
(4)��������ʵ����̣��ж�NH3��H2O��Cu2+����λ������NH3____H2O(������������������������С����)��
��.Ni(CO)6Ϊ��������ṹ�����е���ԭ��λ��������������ģ���λ��CO��������������������������ϡ�
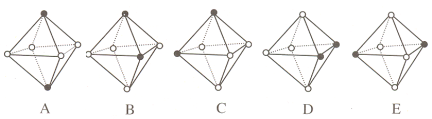
(5)������������CO��λ�廻�� NH3 �õ��µ����������������л�Ϊͬ���칹�����_________��(����ĸ��ţ�����һ�顣ͼ�кڵ�ΪNH3��ԲȦΪCO��Ni��ȥ)
���𰸡��Ǽ��� ƽ���ı��� Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-��Cu(OH)2+4NH3��H2O =[Cu(NH3)4]2++2OH- +4H2O [Cu(NH3)4]SO4.H2O [Cu(NH3)4]SO4���Ҵ��е��ܽ��ԶС����ˮ�е��ܽ�� 2Cu +8NH3��H2O+O2 = 2[Cu(NH3)4]2+ + 4OH��+ 6H2O ���� AE��BCD��������ϣ�������ͬ����������
��������
(1)CCl4��CS2��Ϊ�Ǽ��Է��ӣ�CrO2Cl2����CCl4��CS2�Ȼ��ܣ������������ܿ�֪��CrO2Cl2Ϊ�Ǽ��Է��ӣ���CrO2Cl2Ϊ������ṹ������Oԭ�Ӻ�Clԭ�ӶԵ�������������ͬ�����ӵ�����������IJ������غϣ�ӦΪ���Է��ӣ���ʵ����CrO2Cl2Ϊ�Ǽ��Է��ӣ�˵����Ϊƽ���ı��νṹ��������ԭ�ӶԳƣ�������ԭ�ӶԳƣ�
(2)��ˮ������ͭ��Ӧ����������ͭ��ɫ����������ˮ����ʱ����ˮ��������ͭ��Ӧ���ɿ����Ե�ͭ�����������������ܽ�õ�����ɫ������Һ���漰�����ӷ���ʽΪ��Cu2++2NH3H2O=Cu(OH)2��+2NH4+��Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-��Cu(OH)2+4NH3��H2O =[Cu(NH3)4]2++2OH- +4H2O��
(3)��������ɫ����Һ�����Ҵ�������[Cu(NH3)4]SO4���Ҵ��е��ܽ��С����ˮ�е��ܽ�ȣ����Ի���������ɫ�ľ��壺Cu(NH3)4SO4H2O������Cu���ʵķ�ĩ����NH3��Ũ��Һ�У�ͨ��O2����ַ�Ӧ����Һ������ɫ��˵������ͭ�������ӣ���ϵ����غ��Ԫ���غ�ɵ����ӷ���ʽΪ2Cu +8NH3��H2O+O2 = 2[Cu(NH3)4]2+ + 4OH��+ 6H2O��
(4)������ͭ��Һ�м��������ˮ��������[Cu(NH3)4]2+���ӣ�˵��������Cu2+����λ��������ˮ��ͭ���ӵ���λ������
(5)ͬ���칹���У�������������λ��ƽ���ı������ڡ����λ�û�������������������ϣ����Ի�Ϊͬ���칹����У�A��B(��A��C��A��D��B��E��C��E��D��E��һ�����)��


 ��ʦָ����ĩ��̾�ϵ�д�
��ʦָ����ĩ��̾�ϵ�д� �����ܿ����ϵ�д�
�����ܿ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ߴ�ͭ![]() �㷺Ӧ���ڵ�����ҵ��ij��ͭ��Ʒ�к�Fe��Ni��Ag��Au�����ʣ��õ�ⷨ���о�����
�㷺Ӧ���ڵ�����ҵ��ij��ͭ��Ʒ�к�Fe��Ni��Ag��Au�����ʣ��õ�ⷨ���о�����
![]() ������ͼ1���װ��ͼ�б����缫���Ϻ͵������Һ��_________
������ͼ1���װ��ͼ�б����缫���Ϻ͵������Һ��_________
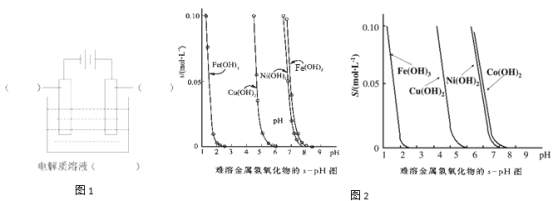
![]() �����Ϻ�ij��ȤС�����Ե��Һ�е����ӽ��з��룬����ͨ���������ϣ���֪������������ڲ�ͬpH�µ��ܽ������
�����Ϻ�ij��ȤС�����Ե��Һ�е����ӽ��з��룬����ͨ���������ϣ���֪������������ڲ�ͬpH�µ��ܽ������![]() ��ͼ
��ͼ![]() ��
��
![]() ���ͼ��������ͬ�¶���
���ͼ��������ͬ�¶���![]() ��
��![]() ��
��![]() �ɴ�С��˳��Ϊ ______ ��
�ɴ�С��˳��Ϊ ______ ��
![]() ʱ��Һ��ͭԪ�ص���Ҫ������ʽ�ǣ� ______
ʱ��Һ��ͭԪ�ص���Ҫ������ʽ�ǣ� ______ ![]() д��ѧʽ
д��ѧʽ![]() ��
��
![]() ��Ҫ��ȥ
��Ҫ��ȥ![]() ��Һ�е�����
��Һ�е�����![]() ��Ӧ�ÿ�����Һ��pHΪ ______
��Ӧ�ÿ�����Һ��pHΪ ______ ![]() ����ĸ
����ĸ![]() ��
��
A.![]()
![]()
![]()
![]() ��
��![]() ��Һ�к���������
��Һ�к���������![]() ���ʣ� ______
���ʣ� ______ ![]() ������������������
������������������![]() ͨ��������ҺpH�ķ�������ȥ�������� ______ ��
ͨ��������ҺpH�ķ�������ȥ�������� ______ ��
![]() ��ͬѧ�������ͼ3�������裬˳���������Һ�е����ֽ���Ԫ�صķ��룮�÷������Լ�XΪ ______ ��
��ͬѧ�������ͼ3�������裬˳���������Һ�е����ֽ���Ԫ�صķ��룮�÷������Լ�XΪ ______ ��![]() ______ ������b�Ļ�ѧʽΪ ______ ��
______ ������b�Ļ�ѧʽΪ ______ ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����÷�Ӧ![]() ���ɵ�ص�װ����ͼ��ʾ���˷�������ʵ����Ч�������������ŷţ����ỷ����Ⱦ�����ܳ�����û�ѧ�ܡ�����˵����ȷ����
���ɵ�ص�װ����ͼ��ʾ���˷�������ʵ����Ч�������������ŷţ����ỷ����Ⱦ�����ܳ�����û�ѧ�ܡ�����˵����ȷ����![]()
![]()

A.���������缫�������غ������Ҳ�缫
B.�缫A����ӦʽΪ![]()
C.Ϊʹ��س����ŵ磬���ӽ���Ĥ��ѡ�������ӽ���Ĥ
D.����![]() ������ʱ��ת�Ƶ�����Ϊ
������ʱ��ת�Ƶ�����Ϊ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2L���ܱ������з�����Ӧ��4A��s��+3B��g��2C��g��+D��g����2min��B��С��1.2mol���йش˷�Ӧ��˵����ȷ���ǣ�������
A. �� 2min �ڵķ�Ӧ���ʣ��� C ��ʾ�� 0.4mol/��Lmin��
B. �ֱ��� B��C��D ��ʾ��ѧ��Ӧ�������ֵ�� 3��2��1
C. �ﵽ��ѧ��Ӧ��ʱ��B ����ת����Ϊ 100%
D. ������������ A ��Ͷ�������Լӿ�÷�Ӧ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ƭ��ͭʵ���У�װ������ͼ��ʾ����Ϊ��ߵ��Ч�������ǰ��Ƭ��������NaOH��Һ��ϡ�����ˮϴ�ӡ�����˵������ȷ����
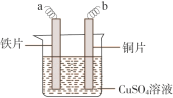
A.ϡ�������Ҫ�����dz�ȥ����
B.a�ӵ�Դ������b�ӵ�Դ����
C.��ƹ�����c(Cu2+)�������ֲ���
D.����������Ӧ��Cu2+��2e�C = Cu
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л������������������ܲ��ɷ֣������е�һЩ���ⳣ�漰��ѧ֪ʶ��
(1)�����м���ʳƷ��

�ٻ����������������������ҪӪ������Ϊ___________(����ࡱ������֬�������ʡ�)��
�ڳԷ�ʱ������һ�����о�����ζ������Ϊ���۷�����_____________(����ĸ)��Ӧ��
A.�ֽ� B.ˮ�� C.�ѽ�
(2)���ճ������У����������������________��
A.��ȼ�շ�����ë֯Ʒ����֯Ʒ
B.�ô���ϴ�ӹ����ϵ�����
C.������ζ�ķ�������ƺ��״�
D.�õ�����Һ����ӵ�ʳ�κͲ������ʳ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���2molSO2��1molO2����10L�����ܱ������У�������Ӧ��2SO2(g)+O2(g) 2SO3(g)��H�T��196kJ/mol��5minʱ�ﵽƽ�⣬��÷�Ӧ����166.6kJ������˵��������ǣ� ��
A.0~5min�ڣ���O2��ʾ��ƽ����Ӧ������(O2)�T0.017mol��(L��min)-1
B.�������䣬��ʼʱ�������г���4molSO2��2molO2��ƽ��ʱ��Ӧ����С��333.2kJ
C.������O2��Ũ�ȣ���SO2��ת��������
D.![]() ��ֵ����ʱ���÷�Ӧ�ﵽƽ��״̬
��ֵ����ʱ���÷�Ӧ�ﵽƽ��״̬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)���������ĸ���������ԭ�������ɴ�С��˳��������________��
��0.5 mol����
�ڱ�״����22.4 L����
��4 ��ʱ9 mLˮ
��0.2 mol������(Na3PO4)
(2)����m gij���壬������ԭ�ӷ��ӣ���Ħ������ΪM g��mol��1���������ӵ�������NA��ʾ���������Ϸ��ż���Ӧ������д���пո�
�ٸ���������ʵ���Ϊ________mol��
�ڸ���������ԭ������Ϊ________����
�۸������ڱ�״���µ����Ϊ________L��
�ܸ�������ȫ����ˮ�γ�V L��Һ(�����Ƿ�Ӧ)��������Һ�����ʵ���Ũ��Ϊ________mol��L��1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϵͳ������������д���ṹ��ʽ��
��1��3-��-2-������1����ϩ�ṹ��ʽΪ______________________��
��2��![]() ����Ϊ___________________________��
����Ϊ___________________________��
��3��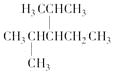 ����Ϊ___________________________________��
����Ϊ___________________________________��
��4��![]() ����Ϊ___________________________��
����Ϊ___________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com