
【题目】实验室用63%的浓HNO3(其密度为1.4g/mL)配制240mL0.50mol/L稀HNO3,若实验仪器有:A.10mL量筒 B.50mL量筒 C.托盘天平 D.玻璃棒 E.100mL容量瓶 F.250mL容量瓶 G.500mL容量瓶 H.胶头滴管 I.200mL烧杯。
(1)此浓硝酸的物质的量浓度为___mol/L。
(2)应量取63%的浓硝酸___mL,应选用的量筒是___(填仪器的字母编号)。
(3)实验时还需选用的仪器有(填序号)D、I、___(填序号)
(4)配制过程中,下列操作会使配制的稀硝酸溶液浓度偏高的是___(填序号)。
①量取浓硝酸的量筒用蒸馏水洗涤2﹣3次,并把洗涤液转入容量瓶
②容量瓶使用时未干燥
③定容时俯视刻度线
④定容时不小心有少量蒸馏水滴到瓶外
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
【答案】14.0 8.9 A F、H ①③
【解析】
(1)由![]() 可得:63%的浓HNO3(其密度为1.4g/mL)的物质的量浓度
可得:63%的浓HNO3(其密度为1.4g/mL)的物质的量浓度![]() /L=14.0mol/L,故答案为:14.0;
/L=14.0mol/L,故答案为:14.0;
(2)由于无240mL容量瓶,故应选用250mL容量瓶,配制出250mL溶液,浓硝酸稀释前后溶质的物质的量不变,有c(浓)×V(浓)=c(稀)×V(稀)得:V(浓)=![]() ≈8.9mL,应选用10mL量筒量取,故答案为:8.9;A;
≈8.9mL,应选用10mL量筒量取,故答案为:8.9;A;
(3)据配制步骤:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶可知所需的仪器有10mL量筒、烧杯、玻璃棒、250mL容量瓶和胶头滴管,故还需要的仪器有250mL容量瓶和胶头滴管,即F、H,故答案为:F、H;
(4)①量取浓硝酸的量筒用蒸馏水洗涤23次,并把洗涤液转入容量瓶,会导致溶质的量偏多,则浓度偏高,①正确;
②容量瓶使用时未干燥,对浓度无影响,②错误;
③定容时俯视刻度线,导致溶液体积偏小,浓度偏高,③正确;
④定容时不小心有少量蒸馏水滴到瓶外,无影响,④错误;
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线是正常的,再加蒸馏水补至刻度线会导致溶液体积偏大,浓度偏低,⑤错误;
故答案为:①③。


科目:高中化学 来源: 题型:
【题目】普伐他汀是一种调节血脂的药物,其结构如图所示(未表示出其空间构型)。下列关于普伐他汀的性质描述不正确的是( )
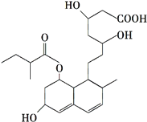
A. 3个—OH皆可因催化氧化生成醛基
B. 能使酸性KMnO4溶液褪色
C. 能发生加成、取代、消去反应
D. 1 mol该物质最多可与2mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求回答问题。
(1)Si的基态原子核外电子排布式____,S的基态原子核外有____个未成对电子
(2)用“<”“>”填空
离子半径 | 电负性 | 熔点 | 酸性 |
O2-____Na+ | N___O | 金刚石_____晶体硅 | 硫酸___高氯酸 |
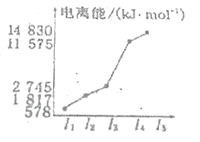
(3)第三周期某元素的电离能情况如图所示,则该元素位于元素周期表第____列
(4)Mn、Fe均为第4周期的过渡元素,两元素的部分电离能数据列于下表:
元素 | Mn | Fe | |
电离能/kJ·mol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,对此,你的解释是______。
(5)下图能表示HF分子形成的是(____)
a.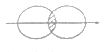 b.
b.![]()
c.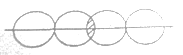 d.
d.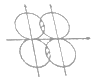
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去某物质中所含的杂质,周佳敏同学做了以下四组实验,其中她所选用的试剂或操作方法正确的是( )

A. ①②③ B. ②③④ C. ①③④ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高岭土主要由高岭石![]() 长期风化而成,其中还含有一定量的白云石
长期风化而成,其中还含有一定量的白云石![]() ,高岭土是制作陶瓷的原料。完成下列填空:
,高岭土是制作陶瓷的原料。完成下列填空:
(1)矿石中除![]() 外的三种非金属元素的原子半径从小到大的顺序是______。硅原子的核外电子排布式是___,镁原子核外有_________种能量不同的电子。
外的三种非金属元素的原子半径从小到大的顺序是______。硅原子的核外电子排布式是___,镁原子核外有_________种能量不同的电子。
(2)判断![]() 的金属性强于
的金属性强于![]() 的事实是____________。
的事实是____________。
a. ![]() 的碱性强于
的碱性强于![]()
b. ![]() 微溶于水,
微溶于水,![]() 难溶于水
难溶于水
c. 与热水反应,钙比镁剧烈
d. 单质钙保存在煤油里,单质镁不需要
(3)![]() 和
和![]() 同是ⅣA族元素的氧化物,
同是ⅣA族元素的氧化物,![]() 的熔点明显比
的熔点明显比![]() 高的原因是________。
高的原因是________。
(4)氮化硅(![]() )是一种新型陶瓷材料,制备反应如下:
)是一种新型陶瓷材料,制备反应如下:![]() ,该反应的平衡常数表达式___________;反应达到平衡后,若增大
,该反应的平衡常数表达式___________;反应达到平衡后,若增大![]() 浓度,则
浓度,则![]() 值____________(填“增大”“减小”或“不变”)。
值____________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某天然黄铜矿主要成分为![]() (含
(含![]() ),为测定该黄铜矿的纯度,某同学设计了如下实验:
),为测定该黄铜矿的纯度,某同学设计了如下实验:
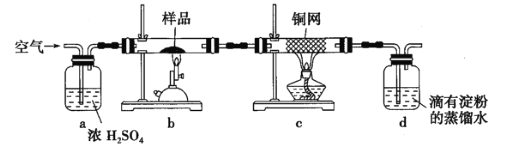
称取硏细的黄铜矿样品![]() 煅烧,生成
煅烧,生成![]() 、
、![]() 、
、![]() 和
和![]() 气体,实验后取
气体,实验后取![]() 中溶液的1/10置于锥形瓶中,用
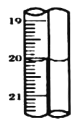
中溶液的1/10置于锥形瓶中,用![]() 标准碘溶液进行滴定,初读数为
标准碘溶液进行滴定,初读数为![]() ,末读数如图所示,完成下列填空:
,末读数如图所示,完成下列填空:
(1)实验中称量样品所需定量仪器为____________。
(2)装置![]() 的作用是____________。
的作用是____________。
(3)上述反应结束后,仍需通一段时间的空气,其目的是____________。
(4)滴定时,标准碘溶液所耗体积为______![]() 。用化学方程式表示滴定的原理:____________。
。用化学方程式表示滴定的原理:____________。
(5)计算该黄铜矿的纯度____________。
(6)工业上利用黄铜矿冶炼铜产生的炉渣(含![]() ,
,![]() ,
,![]() ,
,![]() )可制备
)可制备![]() 。选用提供的试剂:稀盐酸、稀硫酸、
。选用提供的试剂:稀盐酸、稀硫酸、![]() 溶液、
溶液、![]() 溶液、
溶液、![]() 溶液,设计实验验证炉渣中含有
溶液,设计实验验证炉渣中含有![]() 。所选试剂为____________,证明炉渣中含有
。所选试剂为____________,证明炉渣中含有![]() 的实验方案为____________。
的实验方案为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)中国的高铁技术居于国际领先地位。
①高铁座椅内填充有聚氨酯软质泡沫。聚氨酯属于____(填字母)。
a.金属材料 b.无机非金属材料 c.有机高分子材料
②高铁信息传输系统中使用了光导纤维。光导纤维的主要成分是____(填字母)。
a.铜 b.石墨 c.二氧化硅
③高铁轨道建设需用大量水泥。生产水泥的主要原料为黏土和____(填字母)。
a.石灰石 b.粗盐 c.纯碱
(2)营养均衡有利于身体健康。
①人体内提供能量的主要营养物质为____、糖类和蛋白质。淀粉在人体内水解的最终产物是____。
②维生素是人体需要的营养物质。如图为某品牌维生素C泡腾片说明书的部分内容。该泡腾片中添加的着色剂是____,甜味剂是___。泡腾片溶于水时产生“沸腾”效果,是由于添加的酒石酸和___反应释放出了气体。

(3)煤炭在我国能源结构中占有重要地位,合理使用有利于社会可持续发展。
①控制燃煤产生的SO2排放,能够减少____型酸雨的形成。燃煤排放的烟气中还含有其他污染物,请列举一种:_____。
②燃煤产生的CO2用NH3处理可生产多种化工产品。用氨水吸收CO2可制得碳铵(NH4HCO3),写出该反应的化学方程式_____。用液氨与CO2反应可制备尿素[CO(NH2)2]。尿素和碳铵这两种氮肥中,氮元素的质量分数较高的是_____。
③煤的气化和液化是实现能源清洁化的重要途径。水煤气中CO和H2在加热、加压和催化剂存在条件下可以合成液体燃料(CH3OH),该反应的化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C4H6O5的有机物A有如下性质( )
①1mol A+2mol NaOH→正盐,②A+RCOOH或ROH![]() 有香味的物质(R为烃基),③1mol A
有香味的物质(R为烃基),③1mol A![]() 1.5mol气体,④A的分子内脱水产物(不是环状化合物)可使溴水褪色.
1.5mol气体,④A的分子内脱水产物(不是环状化合物)可使溴水褪色.
根据以上信息,对A的结构判断错误的是( )
A.肯定没有碳碳双键
B.有两个羧基
C.肯定有醇羟基
D.有RCOOR'结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Y原子的最外层电子数是其电子层数的3倍。下列说法正确的是( )
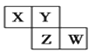
A. 元素Y和元素Z的最高正化合价相同
B. 单核阴离子半径的大小顺序为:r(W)>r(Y)>r(Z)
C. 元素Y和元素Z的氢化物中均只存在极性共价键
D. 元素W的最高价氧化物对应水化物的酸性最强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com