
【题目】一定温度的恒容绝热闭容器中进行如下可逆反应![]() 下列叙述中,能说明反应已达到化学平衡状态的是
下列叙述中,能说明反应已达到化学平衡状态的是
①A、B、C的分子数之比为1:2:3
②单位时间内生成 amolA,同时生成3amolC
③![]() 的物质的量浓度不再变化
的物质的量浓度不再变化
④![]() :
:![]() :
:![]() :2:3
:2:3
⑤混合气体的密度不再变化
⑥容器内的压强不再变化
A.②③⑥B.③④⑥C.②③D.①②⑤
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】进行下列实验,相关说法正确的是

A. 图甲:蒸干NH4Cl饱和溶液制备NH4Cl晶体
B. 图乙:形成美丽的红色喷泉,证明HC1极易溶于水
C. 图丙:配制一定物质的量浓度的NaOH溶液,定容时如图则所配NaOH溶液浓度偏低
D. 图丁:所示装置用于除去碳酸氢钠固体中的少量碳酸钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,水作为还原剂的是( )
A.2F2 + 2H2O = 4HF + O2B.Na2O + H2O = NaOH
C.Br2 + H2O ![]() HBr + HBrOD.2Na + 2H2O = 2NaOH + H2↑
HBr + HBrOD.2Na + 2H2O = 2NaOH + H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国西部地区有丰富的盐湖资源,对盐湖矿产资源的综合开发利用是西部大开发的重要课题之一
.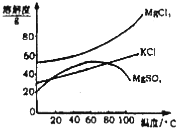
I.某研究性学习小组拟取盐湖苦卤的浓缩液![]() 富含
富含![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 等
等![]() ,来制取较纯净的氯化钾晶体及液溴,他们设计了如下流程:
,来制取较纯净的氯化钾晶体及液溴,他们设计了如下流程:
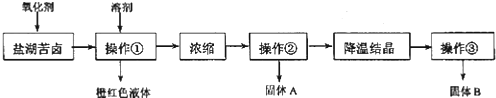
![]() 某同学提出了另一种新方案,对上述操作①后无色溶液进行除杂提纯,无色溶液中先加试剂A,再加试剂B,最后加试剂
某同学提出了另一种新方案,对上述操作①后无色溶液进行除杂提纯,无色溶液中先加试剂A,再加试剂B,最后加试剂![]() 常见的盐
常见的盐![]() ,其方案如下:
,其方案如下:
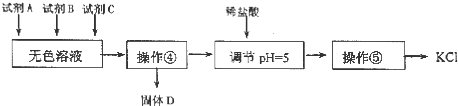
下列说法不正确的是
A.要从橙红色液体中分离出单质溴,可采取的操作是蒸馏
B.操作![]() 为过滤,主要目的是为了除去
为过滤,主要目的是为了除去![]()
C.试剂C为![]() ,固体D主要为
,固体D主要为![]() ,还有少量的
,还有少量的![]()
D.若在操作![]() 结束后发现溶液略有浑浊,应采取的措施是更换滤纸,重新过滤
结束后发现溶液略有浑浊,应采取的措施是更换滤纸,重新过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一密闭容器中发生如下可逆反应:![]() ;
;![]() 若起始时E浓度为a
若起始时E浓度为a![]() ,F、G浓度均为0,达平衡时E浓度为0.5a
,F、G浓度均为0,达平衡时E浓度为0.5a![]() ;若E的起始浓度改为2a
;若E的起始浓度改为2a![]() ,F、G浓度仍为0,当达到新的平衡时,下列说法正确的是
,F、G浓度仍为0,当达到新的平衡时,下列说法正确的是
A.升高温度时,正反应速率加快、逆反应速率减慢
B.若![]() ,容器体积保持不变,新平衡下E的体积分数为
,容器体积保持不变,新平衡下E的体积分数为![]()
C.若![]() ,容器体积保持不变,新平衡下F的平衡浓度小于
,容器体积保持不变,新平衡下F的平衡浓度小于![]()
![]()
D.若![]() ,容器压强保持不变,新平衡下E的物质的量为amol
,容器压强保持不变,新平衡下E的物质的量为amol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)M与Q是同素异形体,由M=Q;△H = -19KJ/mol可知,M比Q________(填稳定、不稳定)。
(2)已知:![]()
![]()
请写出CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式_________________。
(3)在与外界隔离的体系中,自发过程将导致体系的熵__________,(填“增大”、“减小”、“不变”);对于同一种物质,________时熵值最大(填“固态”、“液态”、“气态”)。
(4)某工厂实验室用CO和H2制备CH3OH,其原理为:![]() 该温度下的化学平衡常数表达式__________________;若在298K、398K时化学平衡常数分别为K1、K2,则K1 ___ K2(填“>”、“<”、“=”)。
该温度下的化学平衡常数表达式__________________;若在298K、398K时化学平衡常数分别为K1、K2,则K1 ___ K2(填“>”、“<”、“=”)。
(5)500℃条件下,对于反应![]() ,K=2.33 ,测得某时刻,A(g)、B(g)、C(g)的浓度均为0.5mol/L,则此时v(正) ______ v(逆)(填“>”“<”或“=”)。
,K=2.33 ,测得某时刻,A(g)、B(g)、C(g)的浓度均为0.5mol/L,则此时v(正) ______ v(逆)(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
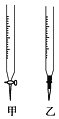
【题目】常温下,用0.1000molL-1NaOH溶液滴定20.00mL 0.1000molL-1CH3COOH溶液所得滴定曲线如图:
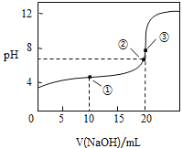
(1)在整个实验过程中,不需要的仪器是 ______ (填序号).
a.100mL容量瓶 b.锥形瓶 c.滴定管夹 d.漏斗 e.玻璃棒 f.滴定管
(2)点②所示溶液为中性:c(Na+)________c(CH3COO-)(填“>”“<”或“=”)。
(3)盛装标准NaOH溶液选择图中滴定管_________(填标号)。
(4)滴定时边滴边摇动锥形瓶,眼睛应注意观察____________。
(5)下列操作会导致测定结果偏低的是______。
A.碱式滴定管在装液前未用标准NaOH溶液润洗
B.滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出
C.碱式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D.达到滴定终点时,仰视读数
(6)氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。测血钙的含量时,进行如下实验:
①可将4mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20mL l.0×l0-4mol/L的KMnO4溶液。
Ⅰ、滴定终点的现象是_________________________________。
Ⅱ、计算:血液中含钙离子的浓度为______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以含锂电解铝废渣(主要成分为LiF、AlF3、NaF,少量CaO等)为原料,生产碳酸锂的工艺流程如下:(已知:常温下,LiOH可溶于水,Li2CO3微溶于水)
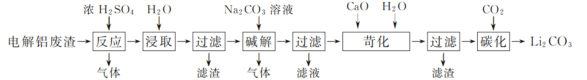
(1)含锂电解铝废渣与浓硫酸在200~400 ℃条件下反应2 h,加水浸取后过滤,得到的滤渣主要成分是________(填化学式)。
(2)流程中浸取后的过滤操作需要趁热在恒温装置中进行,否则会导致Li2SO4的收率下降,原因是________。(已知部分物质的溶解度数据见下表)
温度/℃ | Li2SO4/g | Al2(SO4)3/g | Na2SO4/g |
0 | 36.1 | 31.2 | 4.9 |
10 | 35.4 | 33.5 | 9.1 |
20 | 34.8 | 36.5 | 19.5 |
30 | 34.3 | 40.4 | 40.8 |
40 | 33.9 | 45.7 | 48.8 |
(3)40℃下进行碱解反应,得到粗碳酸锂与氢氧化铝的混合滤渣,生成氢氧化铝的离子方程式为________。
(4)苛化过程中加入的氧化钙将不溶性的碳酸锂转化成氢氧化锂溶液。若氧化钙过量,则可能会造成________。
(5)碳化反应中,CO2的吸收采用了气、液逆流的方式,这样做的优点是________。整个工艺流程中可以循环利用的物质有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是一种重要的化工原料,在工农业中都有广泛的应用。
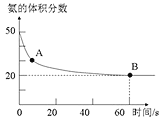
(1)NH3和CO2在120℃和催化剂的作用下可以合成尿素,反应方程式如下:2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(g)。某实验小组向一个容积不变的真空密闭容器中充入![]() 与
与![]() 合成尿素。在恒定温度下,混合气体中
合成尿素。在恒定温度下,混合气体中![]() 的含量随时间的变化关系如图所示
的含量随时间的变化关系如图所示![]() 该条件下尿素为固体
该条件下尿素为固体![]() 。A点的正反应速率
。A点的正反应速率![]() ______ B点的逆反应速率
______ B点的逆反应速率![]() 填“大于”、“小于”或“等于”
填“大于”、“小于”或“等于”![]() ,
,![]() 的平衡转化率为______。
的平衡转化率为______。
(2)氨基甲酸铵![]() 是合成尿素过程中的中间产物。现将体积比为2:1的
是合成尿素过程中的中间产物。现将体积比为2:1的![]() 和
和![]() 混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生反应并达到平衡:
混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生反应并达到平衡:![]() 。实验测得在不同温度下的平衡数据如表:
。实验测得在不同温度下的平衡数据如表:
温度 |
|
|
|
|
|
平衡气体总浓度 |
|
|
|
|
|
①上述反应的焓变:![]() ______
______![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”,下同
”,下同![]() ,熵变
,熵变![]() ______
______![]() 根据表中数据,列出
根据表中数据,列出![]() 时该反应的化学平衡常数的计算式
时该反应的化学平衡常数的计算式![]() ______
______![]() 不要求计算结果
不要求计算结果![]() 。
。
②若从已达平衡状态的上述容器中分离出少量的氨基甲酸铵晶体,反应物的转化率将______![]() 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变”![]() 。
。
(3)向含![]() 的溶液中滴加bL氨水后溶液恰好呈中性,则滴加氨水的过程中水的电离平衡将______
的溶液中滴加bL氨水后溶液恰好呈中性,则滴加氨水的过程中水的电离平衡将______![]() 填“正向”、“不”或“逆向”
填“正向”、“不”或“逆向”![]() 移动,所滴加氨水的浓度为______
移动,所滴加氨水的浓度为______ ![]() 时,
时,![]() 的电离平衡常数
的电离平衡常数 ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com