
【题目】现有几组物质的熔点(℃)的数据:
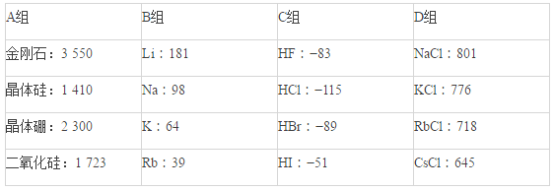
据此回答下列问题:
(1)A组属于___________晶体,其熔化时克服的微粒间的作用力是__________________。
(2)B组晶体共同的物理性质是___________________(填序号)。
①有金属光泽 ②导电性 ③导热性 ④延展性
(3)C组中HF熔点反常是由于_______________________________________。
(4)D组晶体可能具有的性质是_________________(填序号)。
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
(5)D组晶体的熔点由高到低的顺序为NaCl>KCl>RbCl>CsCl,其原因解释为_______________________________。
【答案】原子 共价键 ①②③④ HF分子间能形成氢键,其熔化时需要消耗的能量更多(只要答出HF分子间能形成氢键即可) ②④ D组晶体都为离子晶体,r(Na+)<r(K+)<r(Rb+)<r(Cs+),在离子所带电荷相同的情况下,半径越小,晶格能越大,熔点就越高
【解析】
(1)A组熔点最高,属于原子晶体,原子晶体的构成微粒为原子,微粒间作用力为共价键;
故答案为:原子;共价键;
(2)B组物质为金属,具有金属光泽、导电性、导热性、延展性,故答案为:①②③④;
(3)由于HF分子间存在氢键,导致HF的沸点比其它氢化物的沸点高,故答案为:HF分子间能形成氢键,其熔化时需要消耗的能量更多;
(4)D组物质为离子晶体,离子晶体具有硬而脆、水溶液能导电、固体不能导电而熔融状态能导电的性质,故答案为:②④;
(5)离子晶体中,r(Na+)<r(K+)<r(Rb+)<r(Cs+),在离子所带电荷相同的情况下,半径越小,晶格能越大,熔点就越高;
故答案为:D组晶体都为离子晶体,r(Na+)<r(K+)<r(Rb+)<r(Cs+),在离子所带电荷相同的情况下,半径越小,晶格能越大,熔点就越高。


科目:高中化学 来源: 题型:
【题目】ⅢA、VA族元素组成的化合物AlN、AlP、GaAs等是人工合成的新型半导体材料。回答下列问题:
(1)As基态原子的电子占据了___________个能层,最高能级的电子排布式为___________;和As位于同一周期,且未成对电子数也相同的元素还有_____________种。
(2)元素周期表中,与P紧邻的4种元素中电负性最大的是__________(填元素符号);Si、P、S三种元素的第一电离能由大到小的顺序是______________。
(3)已知AlN、AlP等半导体材料的晶体结构与单晶硅相似,则Al原子的杂化形式为________;晶体结构中存在的化学键有____________(填标号)。
A.离子键 B.![]() 键 C.
键 C.![]() 键 D.配位键
键 D.配位键
(4)砷化镓(GaAs)是继硅晶体之后研究最深入、应用最广泛的半导体材料,它能直接将电能转变为光能,以其为材料制造的灯泡寿命长、耗能少。已知CaAs的晶胞结构如图,晶胞参数![]() =0.565nm,则Ga原子与As原子的核间距为____________pm(列式表示)。
=0.565nm,则Ga原子与As原子的核间距为____________pm(列式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室用食盐晶体与浓硫酸在微热条件下反应制取氯化氢气体,反应的化学方程式为_____.
(2)氯化氢气体的发生装置应该选择装置_____(填装置的编号,下同).由于氯化氢气体有毒,所以实验室用装置D来收集氯化氢,则收集氯化氢时,气体从_____管(填a或b)进入.用水吸收多余的氯化氢气体时,应该选择装置_____,这是为了防止_____.

(3)要得到干燥的氯化氢气体,还需要在制取和收集装置之间插入一个干燥装置D,此时D中装入的液体应该是_____.
(4)为了比较盐酸溶液与氯化氢气体性质的不同之处,取两支试管,一支滴入2~3mL盐酸,另一支收集干燥的氯化氢气体并塞好橡皮塞,然后各放入一片干燥的蓝色石蕊试纸.观察到的现象是_____.再取两支试管,一支滴入2~3mL盐酸,另一支收集干燥的氯化氢气体并塞好橡皮塞,然后各放入一小块锌片.观察到的现象是_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应都有水参加,其中属于氧化还原反应,而水既不做氧化剂,又不做还原剂的是( )
A. Na2O + H2O = 2NaOH B. 2Na + 2H2O = 2NaOH + H2 ↑
C. C12 + H2O = HC1O + HC1 D. C + H2O ![]() CO + H2 ↑
CO + H2 ↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙酮是重要的化工原料,可由苯经下述反应制备:

实验步骤如下:

实验步骤如下:
步骤1:向如图所示的三颈烧瓶中迅速加入13g粉状无水AlCl3和16mL(14g,0.18mol)无水苯。在搅拌下将4mL(4.3g,0.04mol)乙酸酐自滴液漏斗慢慢滴加到三颈烧瓶中。加完后,待反应稍缓和后在沸水浴中搅拌回流,直到不再有HCl气体逸出为止。
步骤2:将反应混合物冷却到室温,在搅拌下倒入18mL浓盐酸和30g碎冰的烧杯中(在通风橱中进行),若仍有固体不溶物,可补加适量浓盐酸使之完全溶解。将混合物转入分液漏斗中,分出有机层,水层用苯萃取两次(每次8mL)。合并有机层,依次用15mL10%NaOH溶液、15mL水洗涤,再用无水MgSO4干燥。
步骤3:先在水浴上蒸馏回收物质A,然后在石棉网上加热蒸去残留的苯,稍冷后改用空气冷凝管蒸馏收集195~202℃馏分,产量约4.1g。
(1)步骤1中搅拌回流时,冷凝水从_____(填“a”或“b”)端进水,倒置漏斗的作用是_____。
(2)步骤2中水层用苯萃取两次(每次8mL),而不萃取一次(16mL)的目的是_____。用15mL10% NaOH溶液洗涤的目的是_____。
(3)步骤3中在水浴上蒸馏回收的物质A为_____。
(4)本次实验苯乙酮的产率为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为一种利用原电池原理设计测定O2含量的气体传感器示意图,RbAg4I5是只能传导Ag+的固体电解质。O2可以通过聚四氟乙烯膜与AlI3 反应生成Al2O 3和I2,通过电池电位计的变化可以测得O2的含量。下列说法正确的是( )

A. 正极反应为:3O2+12e-+4Al3+=2Al2O3
B. 传感器总反应为:3O2+4AlI3+12Ag=2Al2O3+12AgI
C. 外电路转移0.01mol电子,消耗O2的体积为0.56L
D. 给传感器充电时,Ag+向多孔石墨电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷化镍可用于制作发光器件、半导体激光器、太阳能电池和高速集成电路。
(1)基态Ni原子的价电子排布式为 ___,基态As原子电子占据最高能级的电子云轮廓图为 __ 形。
(2)第一电离能As ___Se(填“>”或“<”) ,原因是____。As2O3(砒霜)是两性氧化物,As2O3溶于盐酸生成AsCl3,AsCl3用LiAlH4还原生成AsH3。
(3)①AlH4-的中心原子的杂化方式为___,其空间构型为____,写出一种与AlH4-互为等电子体的分子的化学式___。
②AsH3分子中H—As—H键角__109.5°(填“>”、“=”或“<”)。AsH3沸点低于NH3,其原因是____。
(4)有机砷![]() 是治疗昏睡病不可缺少的药物,该有机砷中存在的化学键的种类为____(填字母编号)。
是治疗昏睡病不可缺少的药物,该有机砷中存在的化学键的种类为____(填字母编号)。
a.离子键 b.σ键 c.π键 d.碳碳双键
(5)砷化镍激光在医学上用于治疗皮肤及粘膜创面的感染、溃疡等,砷化镍晶胞如图所示,该晶胞密度ρ为____g·cm-3(列式即可,不必化简)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)3g氢气的物质的量为________,在标准状况下的体积为_________。
(2)3.01×1023个S约含_____mol S,其质量为_____g。
(3)49 g H2SO4约含有_____个H,共含有_____个原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
(1)CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g)。
已知:C(s)+2H2(g)=CH4(g) ΔH=-75 kJ·mol1
C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol1
C(s)+1/2O2(g)=CO(g) ΔH=-111 kJ·mol1
该催化重整反应的ΔH==______ kJ·mol1。有利于提高CH4平衡转化率的条件是____(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为_______mol2·L2。
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。
相关数据如下表:
积碳反应 CH4(g)=C(s)+2H2(g) | 消碳反应 CO2(g)+C(s)=2CO(g) | ||
ΔH/(kJ·mol1) | 75 | 172 | |
活化能/ (kJ·mol1) | 催化剂X | 33 | 91 |
催化剂Y | 43 | 72 | |
①由上表判断,催化剂X____Y(填“优于”或“劣于”),理由是_________________。在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如图所示。升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是________填标号)。

A.K积、K消均增加 B.v积减小,v消增加
C.K积减小,K消增加 D.v消增加的倍数比v积增加的倍数大
②在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com