
����Ŀ���黯�����������������������뵼�弤������̫���ܵ�غ��ټ��ɵ�·��
��1����̬Niԭ�ӵļ۵����Ų�ʽΪ ___����̬Asԭ�ӵ���ռ������ܼ��ĵ���������ͼΪ __ �Ρ�
��2����һ������As ___Se(����>����������) ��ԭ����____��As2O3(��˪)�����������As2O3������������AsCl3��AsCl3��LiAlH4��ԭ����AsH3��
��3����AlH4-������ԭ�ӵ��ӻ���ʽΪ___����ռ乹��Ϊ____��д��һ����AlH4-��Ϊ�ȵ�����ķ��ӵĻ�ѧʽ___��
��AsH3������H��As��H����__109.5�����>������=������)��AsH3�е����NH3����ԭ����____��
��4���л���![]() �����ƻ�˯������ȱ�ٵ�ҩ����л����д��ڵĻ�ѧ��������Ϊ____(����ĸ���)��
�����ƻ�˯������ȱ�ٵ�ҩ����л����д��ڵĻ�ѧ��������Ϊ____(����ĸ���)��
a�����Ӽ� b������ c������ d��̼̼˫��
��5���黯��������ҽѧ����������Ƥ����ճĤ����ĸ�Ⱦ������ȣ��黯��������ͼ��ʾ���þ����ܶ���Ϊ____g��cm-3(��ʽ���ɣ����ػ���)��

���𰸡�3d84s2 ���壨�Ĵ��� �� AsԪ��ԭ�ӵ�4p����ϵĵ��ӳʰ���״̬���Ƚ��ȶ� sp3 �������� SiH4��CH4 �� Һ̬NH3���Ӽ����γ������AsH3���Ӽ�ֻ�з��»��� abc ![]() ��
��![]() ��
��![]()
��������
��1��Niԭ������Ϊ28����̬Niԭ�ӵļ۵���Ϊ3d�ܼ��ϵ�8�����ӡ�4s�ܼ��ϵ�2�����ӣ���̬Asԭ�Ӻ�������Ų�ʽΪ[Ar]3d104s24p3���û�̬ԭ����ռ������ܼ��ĵ���Ϊ4p���ӣ�Ϊ�����Σ�
��2��ԭ�ӹ���е��Ӵ���ȫ����ȫ�ջ���ʱ���ȶ���
��3����AlH4��������ԭ��Al�ļ۲���ӶԸ���=4+(3+1-4��1)/2=4�Ҳ����µ��Ӷԣ����ݼ۲���ӶԻ��������ж�Alԭ���ӻ���ʽ����ռ乹�ͣ���AlH4����Ϊ�ȵ�����ķ����к���5��ԭ�ӡ��۵�������8��
��AsH3������Asԭ�Ӽ۲���ӶԸ���=3+(5-3��1)/2=4�Һ���1���µ��Ӷԣ��÷���Ϊ�����νṹ���µ��Ӷ���ɼ����Ӷ�֮����ų������ڳɼ����Ӷ�֮����ų�������������Ǽ�С��
�����Ӽ����γ�������⻯���۷е�ϸߣ�
��4���л���![]() �й��۵����д��ڦҼ��������д��ڴ�м��������Ӻ�������֮��������Ӽ���
�й��۵����д��ڦҼ��������д��ڴ�м��������Ӻ�������֮��������Ӽ���
��5���þ�����Niԭ�Ӹ���=4��1/12+4��1/6+2��1/3+2��1/6=2��Asԭ�Ӹ���Ϊ2��Ni��Asԭ�Ӹ���֮��Ϊ2��2=1��1���������=��a��10-10 cm��2��sin60���b��10-10cm=![]() �������ܶ�=
�������ܶ�=![]() ��������㡣
��������㡣
��1��Niԭ������Ϊ28����̬Niԭ�ӵļ۵���Ϊ3d�ܼ��ϵ�8�����ӡ�4s�ܼ��ϵ�2�����ӣ���̬Asԭ�Ӻ�������Ų�ʽΪ[Ar]3d104s24p3����۵����Ų�ʽΪ3d84s2���û�̬ԭ����ռ������ܼ��ĵ���Ϊ4p���ӣ�Ϊ�����Σ�
��2��ԭ�ӹ���е��Ӵ���ȫ����ȫ�ջ���ʱ���ȶ���AsԪ��ԭ�ӵ�4p����ϵĵ��ӳʰ���״̬���Ƚ��ȶ���
��3����AlH4��������ԭ��Al�ļ۲���ӶԸ���=4+(3+1-4��1)/2=4�������µ��Ӷԣ����ݼ۲���ӶԻ������ۣ�Alԭ���ӻ���ʽΪsp3���ռ乹��Ϊ��������ṹ����AlH4����Ϊ�ȵ�����ķ����к���5��ԭ�ӡ��۵�������8����ȵ������� SiH4��CH4��
��AsH3������Asԭ�Ӽ۲���ӶԸ���=3+(5-3��1)/2=4������1���µ��Ӷԣ��÷��ӹ���Ϊ�����Σ��µ��Ӷ���ɼ����Ӷ�֮����ų������ڳɼ����Ӷ�֮����ų������÷����к��йµ��Ӷԣ���������Ǽ�С��С��109.5�㣻
���Ӽ����γ�������⻯���۷е�ϸߣ�Һ̬NH3���Ӽ����γ������AsH3���Ӽ�ֻ�з��»����������۷е�ϸߣ�
��4���л���![]() ���۵����д��ڦҼ��������д��ڴ�м��������Ӻ�������֮��������Ӽ������Ժ������Ӽ����Ҽ����м���
���۵����д��ڦҼ��������д��ڴ�м��������Ӻ�������֮��������Ӽ������Ժ������Ӽ����Ҽ����м���
��ѡabc��
��5���þ�����Niԭ�Ӹ���=4��1/12+4��1/6+2��1/3+2��1/6=2��Asԭ�Ӹ���Ϊ2��Ni��Asԭ�Ӹ���֮��Ϊ2��2=1��1���������=��a��10-10 cm��2��sin60���b��10-10cm=![]() �������ܶ�=
�������ܶ�=![]() =
= g��cm��3��
g��cm��3��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������﮵�������͵���ɫ��Դ��أ�������������������¡�
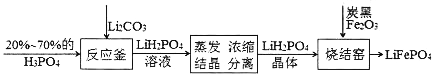
(1)��Ӧ���з�Ӧ�Ļ�ѧ����ʽΪ_______���÷�Ӧ���ֳ��ǽ����Թ�ϵ��P_____C(�>����<��)��
(2)�����£�LiH2PO4��Һ��pH��c(H2PO4-)�ı仯��ͼ1��ʾ��H3PO4��Һ��H2PO4-�ķֲ�����![]() ��pH�ı仯��ͼ2��ʾ[
��pH�ı仯��ͼ2��ʾ[![]() (��PԪ�ص�����)]��
(��PԪ�ص�����)]��
����ͼ1֪����Ũ��ʱLiH2PO4��Һ��pHС��7��������c��ʼ(H2PO4-)���������С��������Ľ���Ϊ__________________��
���ۺ���ͼ����������Ũ�ȴ���1mol/L��H3PO4��Һ�ܽ�Li2CO3��Ҫʹ��Ӧ���е�H3PO4����ȫ��ת����LiH2PO4����Ӧ������Ҫ������Һ��pH=________��
(3)������﮵���ܷ�ӦΪ��LiFePO4+6C![]() Li1-xFePO4+LixC6������еĹ������ʿɴ���Li+�����ʱ��Li+����______(���������������)���ŵ�ʱ��������ӦʽΪ__________________��
Li1-xFePO4+LixC6������еĹ������ʿɴ���Li+�����ʱ��Li+����______(���������������)���ŵ�ʱ��������ӦʽΪ__________________��
(4)������﮵�������ĺ�����ͨ�����·����ⶨ����ȡ1.60g�����������ܽ⣬����Һ�м����Թ�����SnCl2��Һ���ټ���HgCl2������Һ���ö�������������ָʾ������0.030mol/L�ظ������Һ�ζ�����Һ��dz��ɫ��Ϊ����ɫ�������ظ������Һ50.00mL��
��֪��2Fe3++Sn2++6Cl-=SnCl62-+2Fe2+
4Cl-+Sn2++2HgCl2=SnCl62-+Hg2Cl2
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
��ʵ���м���HgCl2������Һ��Ŀ����____________��
�����İٷֺ���Fe(��)=_________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������(��Ҫ�ɷ�Fe2O3��SiO2��������Fe3O4��Al2O3��MgO)������ȫ��Ч��ˮ�������������(K2FeO4)�Ĺ����������£�

��֪��FeO42����ǿ������Һ���ȶ�������Fe(OH)3�������»ᷢ���ֽ⡣
(1)�������ʱ��������������˹����ԭ����_____��
(2)��������ʱ������Ӧ�����ӷ���ʽΪ_____��
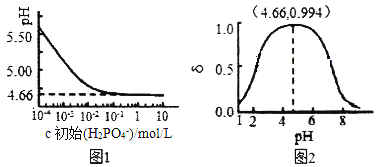
(3)�ڿ��������������������£�̽������Fe2(SO4)3��NaOH���������䣬�ı��������ȶ�K2FeO4���ʵ�Ӱ�죬ʵ������ͼ��ʾ���������ȴ���0.55ʱK2FeO4�IJ����½���ԭ�������_____��

(4)������2����������������Ҫ�ɷ�Ϊ_____(�ѧʽ)��������3��������Һ�к��е���������OH����Cl����SO42����_____��_____(�ѧʽ)��
(5)K2FeO4�ɽ�ˮ�е�H2S����Ϊ�����Σ�ͬʱK2FeO4����ԭΪFe(OH)3����ӦʱK2FeO4��H2S�����ʵ���֮��Ϊ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����м������ʵ��۵�(��)�����ݣ�
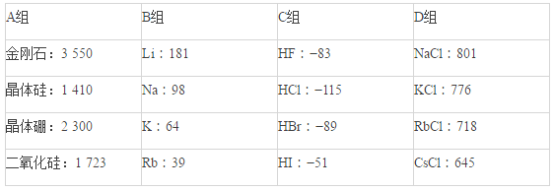
�ݴ˻ش��������⣺
(1)A������___________���壬���ۻ�ʱ�˷����������������__________________��
(2)B�龧�干ͬ������������___________________(�����)��
���н������� �ڵ����� �۵����� ����չ��
(3)C����HF�۵㷴��������_______________________________________��
(4)D�龧����ܾ��е�������_________________(�����)��
��Ӳ��С ��ˮ��Һ�ܵ��� �۹����ܵ��� ������״̬�ܵ���
(5)D�龧����۵��ɸߵ��͵�˳��ΪNaCl>KCl>RbCl>CsCl����ԭ�����Ϊ_______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ī���Σ�(NH4)2Fe(SO4)26H2O��Mr��392����һ����Ҫ�Ļ�ԭ�����ڿ����б�һ����������ȶ���ijѧϰС���������ʵ���Ʊ�������Ī���β��ⶨ�䴿�ȡ�

�ش��������⣺
����ȡĪ����
��1������װ�ã����װ�������ԡ���0.1mol��NH4��2SO4���������ڲ���������______�����������ƣ�����6.0g������м������ƿ�С�
��2���ٴ�Һ©��ƿ�����رջ���K3����K2��K1������55.0mL2mol��L-1ϡ�����ر�K1��Aװ���з�Ӧ�����ӷ���ʽΪ____
�ڴ��������ܽ��K3���ر�K2����ʱ���Կ���������Ϊ_______��ԭ����_______
�۹رջ���K2��K3������100��ˮԡ����B��ˮ�֣�Һ�������Ĥʱ��ֹͣ���ȣ���ȴ�ᾧ��____������ˮ�Ҵ�ϴ�Ӿ��塣�÷�Ӧ�������������������Һ��pH��1��2֮�䣬��Ŀ��Ϊ____
��װ��C������Ϊ ____��װ��C���ڵ�ȱ����____
�ⶨĪ������Ʒ�Ĵ���
��3����ȡ����Ī������Ʒ10.0g������к���ȴ������ˮ���100mL��Һ��ȡ20.00mL��Һ����ϡ���ᣬ��0.1molL-1��KMnO4��Һ�ζ����ﵽ�ζ��յ�ʱ����10.00mlKMnO4��Һ���ζ���Ӧ�����ӷ���ʽΪ____������Ʒ�Ĵ���Ϊ____
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��Һ��c��H+����c��OH�����Ĺ�ϵ�������жϴ������

A. ����������������c��H+����c��OH������KW
B. M��������������c��H+����c��OH����
C. ͼ��T1��T2
D. XZ������������pH��7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��1��105 Pa��298 K�����£�2 mol����ȼ������ˮ�����ų�484 kJ�����������Ȼ�ѧ����ʽ��ȷ����
A. H2(g)��![]() O2(g)===H2O(g) ��H=��242 kJ��mol��1
O2(g)===H2O(g) ��H=��242 kJ��mol��1
B. 2H2(g)��O2(g)===2H2O(l) ��H=��484 kJ��mol��1
C. H2O(g)===H2(g)��![]() O2(g) ��H=��242 kJ��mol��1
O2(g) ��H=��242 kJ��mol��1
D. 2H2(g)��O2(g)===2H2O(g) ��H=��484 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������CO��H2�ڴ����������ºϳɼ״��������ķ�Ӧ���£�CO(g)+2H2(g)![]() CH3OH(g)�������һ�����ܱ������а����ʵ���֮��1��2����CO��H2�����ƽ��������CH3OH����������ڲ�ͬѹǿ�����¶ȵı仯��ͼ��ʾ������˵����ȷ����
CH3OH(g)�������һ�����ܱ������а����ʵ���֮��1��2����CO��H2�����ƽ��������CH3OH����������ڲ�ͬѹǿ�����¶ȵı仯��ͼ��ʾ������˵����ȷ����

A. �÷�Ӧ����H��0����p1��p2
B. ��Ӧ���ʣ�����(״̬A)������(״̬B)
C. ��C��ʱ��COת����Ϊ75%
D. �ں��º�ѹ���������ܱ������г��벻ͬ����CH3OH����ƽ��ʱCH3OH���������Ҳ��ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��ͬ��ͬѹ�£�ͬ�����S18O2���������壨H2S�������ʵ���֮��Ϊ_____������֮��Ϊ_____��ͬ��ͬѹ�£���������S18O2��H2S���ܶ�֮��Ϊ_____��
��2������0.2mol/L��BaCl2��Һ����2L����Һ�к���_____molBa2+��3L����Һ�У�Cl�������ʵ���Ũ����_____mol/L����ԭ��Һȡ��10mL��ϡ�͵�250mL����������Һ�����ʵ���Ũ����_____mol/L�������Һ����200mL������Һ��ǡ�ý�����Һ�еı�������ȫ���������������Һ�����ʵ���Ũ����_____mol/L�����������˺�ϴ�Ӹ��ﲢ���������ù����������_____g��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com