
【题目】已知在1×105 Pa、298 K条件下,2 mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是
A. H2(g)+![]() O2(g)===H2O(g) ΔH=+242 kJ·mol-1
O2(g)===H2O(g) ΔH=+242 kJ·mol-1
B. 2H2(g)+O2(g)===2H2O(l) ΔH=-484 kJ·mol-1
C. H2O(g)===H2(g)+![]() O2(g) ΔH=+242 kJ·mol-1
O2(g) ΔH=+242 kJ·mol-1
D. 2H2(g)+O2(g)===2H2O(g) ΔH=+484 kJ·mol-1
【答案】C
【解析】
A、根据反应放热时焓变符号为负来判断;
B、根据物质的聚集状态来判断;
C、根据氢气燃烧生成水蒸气的逆过程为吸热过程来判断;
D、根据反应放热时焓变符号为负来判断。
A、反应为放热反应,此时焓变符号为负,即H2(g)+1/2O2(g) = H2O(g) ΔH=-242 kJ·mol-1,故A错误;
B、生成的水应该为气态,而不是液态,故B错误;
C、2 mol氢气燃烧生成水蒸气放出484 kJ热量,则1mol氢气燃烧生成水蒸气放出242 kJ 热量,其逆过程就要吸收这些热量,即H2O(g)===H2(g)+1/2O2(g) ΔH=+242 kJ·mol-1,故C正确;
D、反应为放热反应,此时焓变符号为负,即2H2(g)+O2(g)===2H2O(l) ΔH=-484 kJ·mol-1,故D错误;
综上所述,本题选C。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】无色气体N2O4是一种强氧化剂,为重要的火箭推进剂之一。N2O4与NO2转换的热化学方程式为N2O4(g)![]() 2NO2(g) ΔH=+24.4 kJ/mol。
2NO2(g) ΔH=+24.4 kJ/mol。
(1)将一定量N2O4投入固定容积的真空容器中,下述现象能说明反应达到平衡的是 _________。
a.v正(N2O4)=2v逆(NO2)
b.体系颜色不变
c.气体平均相对分子质量不变
d.气体密度不变
达到平衡后,保持体积不变升高温度,再次到达平衡时,混合气体颜色____(填 “变深”“变浅”或“不变”),判断理由_______。
(2)平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数[例如:p(NO2)=p总×x(NO2)]。写出上述反应平衡常数Kp表达式 _______________________(用p总、各气体物质的量分数x表示);影响Kp的因素_________________。
(3)上述反应中,正反应速率v正=k正·p(N2O4),逆反应速率v逆=k逆·p2(NO2),其中k正、k逆为速率常数,则Kp为____(以k正、k逆表示)。若将一定量N2O4投入真空容器中恒温恒压分解(温度298 K、压强100 kPa),已知该条件下k正=4.8×104 s-1,当N2O4分解10%时,v正=______________kPa·s-1。
(4)真空密闭容器中放入一定量N2O4,维持总压强p0恒定,在温度为T时,平衡时N2O4分解百分率为α。保持温度不变,向密闭容器中充入等量N2O4,维持总压强在2p0条件下分解,则N2O4的平衡分解率的表达式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙酮是重要的化工原料,可由苯经下述反应制备:

实验步骤如下:

实验步骤如下:
步骤1:向如图所示的三颈烧瓶中迅速加入13g粉状无水AlCl3和16mL(14g,0.18mol)无水苯。在搅拌下将4mL(4.3g,0.04mol)乙酸酐自滴液漏斗慢慢滴加到三颈烧瓶中。加完后,待反应稍缓和后在沸水浴中搅拌回流,直到不再有HCl气体逸出为止。
步骤2:将反应混合物冷却到室温,在搅拌下倒入18mL浓盐酸和30g碎冰的烧杯中(在通风橱中进行),若仍有固体不溶物,可补加适量浓盐酸使之完全溶解。将混合物转入分液漏斗中,分出有机层,水层用苯萃取两次(每次8mL)。合并有机层,依次用15mL10%NaOH溶液、15mL水洗涤,再用无水MgSO4干燥。
步骤3:先在水浴上蒸馏回收物质A,然后在石棉网上加热蒸去残留的苯,稍冷后改用空气冷凝管蒸馏收集195~202℃馏分,产量约4.1g。
(1)步骤1中搅拌回流时,冷凝水从_____(填“a”或“b”)端进水,倒置漏斗的作用是_____。
(2)步骤2中水层用苯萃取两次(每次8mL),而不萃取一次(16mL)的目的是_____。用15mL10% NaOH溶液洗涤的目的是_____。
(3)步骤3中在水浴上蒸馏回收的物质A为_____。
(4)本次实验苯乙酮的产率为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷化镍可用于制作发光器件、半导体激光器、太阳能电池和高速集成电路。
(1)基态Ni原子的价电子排布式为 ___,基态As原子电子占据最高能级的电子云轮廓图为 __ 形。
(2)第一电离能As ___Se(填“>”或“<”) ,原因是____。As2O3(砒霜)是两性氧化物,As2O3溶于盐酸生成AsCl3,AsCl3用LiAlH4还原生成AsH3。
(3)①AlH4-的中心原子的杂化方式为___,其空间构型为____,写出一种与AlH4-互为等电子体的分子的化学式___。
②AsH3分子中H—As—H键角__109.5°(填“>”、“=”或“<”)。AsH3沸点低于NH3,其原因是____。
(4)有机砷![]() 是治疗昏睡病不可缺少的药物,该有机砷中存在的化学键的种类为____(填字母编号)。
是治疗昏睡病不可缺少的药物,该有机砷中存在的化学键的种类为____(填字母编号)。
a.离子键 b.σ键 c.π键 d.碳碳双键
(5)砷化镍激光在医学上用于治疗皮肤及粘膜创面的感染、溃疡等,砷化镍晶胞如图所示,该晶胞密度ρ为____g·cm-3(列式即可,不必化简)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)甲醇是可再生能源,具有开发应用的广阔前景,回答下列问题:
一定温度下,在一恒容的密闭容器中,由CO和H2合成甲醇:CO(g)+2H2(g)CH3OH(g)
①下列情形不能说明该反应已达到平衡状态的是________(填序号).
A.每消耗1mol CO的同时生成2molH2 B.混合气体总物质的量不变
C.CH3OH、CO、H2的浓度都不再发生变化 D.生成CH3OH的速率与消耗CO的速率相等
②CO的平衡转化率(α)与温度、压强的关系如图所示.A、B两点的平衡常数K(A)________K(B)(填“>”、“=”或“<”).

(2)已知25℃合成氨反应中,1mol N2完全转化为NH3时释放的能量为92.4 kJ。现将1mol N2和3mol H2混合置于2L密闭容器中,反应进行到2s末测得NH3为0.4mol。回答下列问题:
① 该反应的热化学方程式是________ ;
② 该反应达到平衡后,升高温度平衡向________ (填“正反应方向”、“逆反应方向”)移动;加入催化剂平衡________(填“正”、“逆”、 “不”)移动;
③ 前2s内v(H2)是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)3g氢气的物质的量为________,在标准状况下的体积为_________。
(2)3.01×1023个S约含_____mol S,其质量为_____g。
(3)49 g H2SO4约含有_____个H,共含有_____个原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在某密闭容器中进行如下反应:
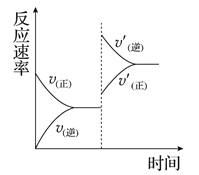
mA(g)+nB(g)![]() pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,
pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,
反应速率随时间的变化过程如图所示,则对该反应的叙述正确的是( )
A. 正反应是吸热反应 B. 逆反应是放热反应
C. m+n<p+q D. m+n>p+q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当发动机工作时,反应产生的NO尾气是主要污染物之一,NO的脱除方法和转化机理是当前研究的热点。请回答下列问题:
(1)已知:2NO(g)+O2 (g) =2NO2(g) △H1= -113kJ/mol
6NO2(g)+O3(g)=3N2O5(g) △H2= -227 kJ/mol
4NO2 (g)+O2(g)=2N2O5(g) △H3= -57 kJ/mol
则 2O3(g)= 3O2(g)是_________反应(填“放热”或“吸热”),以上 O3氧化脱除氮氧化物的总反应是NO(g)+O3(g)=NO2(g)+O2(g) △H4=_______kJ/mol,最后将NO2与_________剂反应转化为无污染的气体而脱除。
步骤 | 反应 | 活化能 | 正反应速率方程 | 逆反应速率方程 |
I | 2NO(g) | Ea1 |
|
|
II | N2O2(g)+O2(g) | Ea2 |
|
|
(2)已知:2NO(g)+O2(g) ![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
①表中k1、k2、k3、k4是只随温度变化的常数,温度升高将使其数值_____(填“增大”或“减小”)。
②反应I瞬间建立平衡,因此决定2NO(g)+O2(g)![]() 2NO2(g)反应速率快慢的是反应II,则反应I与反应II的活化能的大小关系为Ea1____Ea2(填“>”“<”或“=”),请依据有效碰撞理论微观探析其原因______________________________________________。
2NO2(g)反应速率快慢的是反应II,则反应I与反应II的活化能的大小关系为Ea1____Ea2(填“>”“<”或“=”),请依据有效碰撞理论微观探析其原因______________________________________________。
③一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)的速率方程为
2NO2(g)的速率方程为![]() ,则k=_______ (用k1、k2、k3表示)。
,则k=_______ (用k1、k2、k3表示)。
(3)将一定量的 NO2放入恒容密闭容器中发生下列反应:2NO2(g) ![]() 2NO(g)+O2(g),测得其平衡转化率α(NO2)随温度变化如图所示,从 b 点到 a 点降温平衡将向_____移动。图中 a点对应温度下,NO2的起始压强为 160kPa,该温度下反应的平衡常数Kp= __________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
2NO(g)+O2(g),测得其平衡转化率α(NO2)随温度变化如图所示,从 b 点到 a 点降温平衡将向_____移动。图中 a点对应温度下,NO2的起始压强为 160kPa,该温度下反应的平衡常数Kp= __________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com