
【题目】下列化学用语错误的是
A.氟化钠的电子式: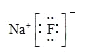 B.CO2的结构式:O=C=O
B.CO2的结构式:O=C=O
C.硫化氢的电子式: D.CH3Cl的电子式
D.CH3Cl的电子式
【答案】C
【解析】
A.氟化钠为离子化合物,钠离子与负离子通过离子键结合;
B.二氧化碳中碳原子与两个氧原子分别共用2对电子;
C.硫化氢为共价化合物,氢原子与硫原子通过共用电子对结合;
D.一氯甲烷中碳原子分别与3个H共用3对电子,与1个Cl共用1对电子。
A.氟化钠为离子化合物,钠离子与负离子通过离子键结合,电子式: ,故A正确;
,故A正确;
B.二氧化碳中碳原子与两个氧原子分别共用2对电子,结构简式为:O=C=O,故B正确;
C.H2S为共价化合物,硫原子中最外层有8个电子达到稳定结构,分子中存在两个H﹣S键,电子式为:![]() ,故C错误;
,故C错误;
D.一氯甲烷中碳原子分别与3个H共用3对电子,与1个Cl共用1对电子,电子式: ,故D正确;
,故D正确;
故答案选C。


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案科目:高中化学 来源: 题型:
【题目】以硫铁矿烧渣(主要成分Fe2O3、SiO2,少量的Fe3O4、Al2O3、MgO)生产安全高效的水处理剂高铁酸钾(K2FeO4)的工艺流程如下:

已知:FeO42﹣在强碱性溶液中稳定,但在Fe(OH)3催化作用下会发生分解。
(1)“酸浸”时加入硫酸的量不宜过多的原因是_____。
(2)“氧化”时发生反应的离子方程式为_____。
(3)在控制其他条件不变的情况下,探究保持Fe2(SO4)3和NaOH总质量不变,改变其质量比对K2FeO4产率的影响,实验结果如图所示,当质量比大于0.55时K2FeO4的产率下降的原因可能是_____。

(4)“过滤2”产生的滤渣的主要成分为_____(填化学式),“过滤3”所得滤液中含有的阴离子有OH﹣、Cl﹣、SO42﹣、_____、_____(填化学式)。
(5)K2FeO4可将水中的H2S氧化为硫酸盐,同时K2FeO4被还原为Fe(OH)3,则反应时K2FeO4与H2S的物质的量之比为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在1×105 Pa、298 K条件下,2 mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是
A. H2(g)+![]() O2(g)===H2O(g) ΔH=+242 kJ·mol-1
O2(g)===H2O(g) ΔH=+242 kJ·mol-1
B. 2H2(g)+O2(g)===2H2O(l) ΔH=-484 kJ·mol-1
C. H2O(g)===H2(g)+![]() O2(g) ΔH=+242 kJ·mol-1
O2(g) ΔH=+242 kJ·mol-1
D. 2H2(g)+O2(g)===2H2O(g) ΔH=+484 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用CO和H2在催化剂的作用下合成甲醇,发生的反应如下:CO(g)+2H2(g)![]() CH3OH(g),在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是
CH3OH(g),在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是

A. 该反应的△H<0,且p1<p2
B. 反应速率:ν逆(状态A)>ν逆(状态B)
C. 在C点时,CO转化率为75%
D. 在恒温恒压条件下向密闭容器中充入不同量的CH3OH,达平衡时CH3OH的体积分数也不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用下图装置探究验证黄铜矿(主要成分CuFeS2)在空气中的氧化产物并测定CuFeS2的纯度(杂质为SiO2)。
实验步骤:①组装好仪器,检查装置的气密性良好。②加入药品,打开弹簧夹,从左口不断鼓入空气。③点燃B处的酒精喷灯,高温灼烧石英管中黄铜矿的样品。

请回答下列问题。
(1)仪器A中的试剂是________,其作用为________。
(2)为检验灼烧氧化黄铜矿产生的气体,则C、D中的试剂可选择________(多选)。
a.Na2S溶液、NaOH溶液
b.BaCl2溶液、NaOH溶液
c.品红溶液、NaOH溶液
d.KMnO4溶液、NaOH溶液
(3)查阅资料:
①样品经煅烧后得到的固体可能为泡铜(Cu、Cu2O)和熔渣(Fe2O3、FeO)。
②Cu2O与稀H2SO4的反应为:Cu2O+H2SO4=Cu+CuSO4+H2O
探究Ⅰ:为验证熔渣的成分,取分离出的熔渣少许于试管中,加入适量的稀硫酸溶解,取两份所得液。完成下表中横线上的内容。
试样 | 加入试剂及操作 | 实验现象 | 得出结论 |
第一份 | 滴入几滴K3Fe(CN)6]溶液 | ________ | 含FeO |
第二份 | 滴入几滴________溶液 | 溶液变为血红色 | 含Fe2O3 |
探究Ⅱ:设计实验方案验证泡铜中是否含有Cu2O?________。
(4)为测定CuFeS2的纯度,称取a g的黄铜矿样品充分燃烧后,甲、乙两组同学设计如下两个不同的实验方案(以下纯度结果均用含相应字母的代数式表示)。
甲方案:若C试管中为足量的H2O2和NaOH的混合溶液,吸收完气体后向C中加入过量的BaCl2溶液振荡且静置,经过滤后处理得到固体为w g,则CuFeS2的纯度为________。写出C试管中吸收气体时的总反应的离子方程式________。
乙方案:从上述煅烧产物中分离出泡铜,使其完全溶于稀硝酸并配成250mL的溶液,取出25.00mL该溶液用c mol·L-1的标准液EDTA(用H2Y2-表示)滴定至终点(滴定荆不与杂质反应),消耗EDTA标准液V mL,则CuFeS2的纯度为________。(滴定时的反应为:Cu2++H2Y2-=CuY2-+2H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.0 molPCl3和1.0 molCl2充入体积不变的密闭容器中,在一定条件下发生下述反应:
PCl3(g)+ Cl2(g)![]() PCl5(g)达到平衡时, PCl5为0.40 mol,如果此时移走1.0 molPCl3和0.50 molCl2,在相同温度下再达平衡时 PCl5的物质的量是
PCl5(g)达到平衡时, PCl5为0.40 mol,如果此时移走1.0 molPCl3和0.50 molCl2,在相同温度下再达平衡时 PCl5的物质的量是
A. 0.40 mol B. 小于0.20 mol C. 0.20 mol D. 大于0.20 mol,小于0.40 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气排放的CO、NOx等气体是大气污染的主要来源,NOx也是雾天气的主要成因之一。
(1)科学家研究利用催化技术将尾气中有害的NO和CO转变成无毒的气体,其热化学方程式为:2CO(g)+2NO(g)![]() 2CO2(g)+N2(g) △H1=-746.5kJ·mol—1
2CO2(g)+N2(g) △H1=-746.5kJ·mol—1
已知:2C(s)+O2(g)![]() 2CO(g) △H2=-221.0kJmol—1
2CO(g) △H2=-221.0kJmol—1
CO2(g)![]() C(s)+O2(g) △H3=+393.5kJmol—1
C(s)+O2(g) △H3=+393.5kJmol—1
①C(s)的然烧热(△H)为_____________。
②NO(g)分解成两种气体单质的热化学方程式为_____________。
(2)一定温度下,向初始容积均为2L的A、B、C三个容器中,均投入5 mol CO气体和4 mol NO气体发生如下反应:2CO(g)+2NO(g) ![]() 2CO2(g)+N2(g)
2CO2(g)+N2(g)

①上图表示该反应中NO的平衡转化率(![]() )随温度、压强变化的示意图,则X代表的物理量是______,Y1_ Yz(填“>”或“<”)
)随温度、压强变化的示意图,则X代表的物理量是______,Y1_ Yz(填“>”或“<”)
②反应过程中,A容器中保持恒温恒压,B容器中保持恒温恒容,C容器中保持绝热恒容。下列说法错误的是________。
a.B、C两个容器中反应达到平衡所用的时长为:tB>tC
b.3个容器中NO的平衡转化率的大小顺序为![]() >
>![]() >
>![]()
c.当A容器内气体平均摩尔质量不变时,说明该反应处于化学平衡状态
d.当B容器内气体密度保持不变时,说明该反应处于化学平衡状态
③当B容器中保持平衡时,NO所占体积分数为25%。则相同温度下,A容器中逆反应的平衡常数K=_________(保留两位有效数字)
(3)利用反应NO2+NH3→N2+H2O(未配平)消除用电器NO2的简易装置如图所示。

①a电极上的反应式为_____________。
②常温下,若用该电池电解0.6L,饱和食盐水,一段时间后,测得饱和食盐水pH变为13,则理论上b电极上消耗B气体的体积为_______mL(标准状况;假设电解过程中溶液体积不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)同温同压下,同体积的S18O2和硫化氢气体(H2S)的物质的量之比为_____,质量之比为_____;同温同压下,等质量的S18O2和H2S的密度之比为_____;
(2)现有0.2mol/L的BaCl2溶液,则2L该溶液中含有_____molBa2+;3L该溶液中,Cl﹣的物质的量浓度是_____mol/L,将原溶液取出10mL,稀释到250mL,则所得溶液的物质的量浓度是_____mol/L,向该溶液加入200mL硫酸溶液,恰好将此溶液中的钡离子完全沉淀,则该硫酸溶液的物质的量浓度是_____mol/L,将沉淀过滤后洗涤干燥并称量,所得固体的质量是_____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1871年门捷列夫最早预言了类硅元素锗,1886年德国化学家温克勒发现和分离了锗元素,并以其祖国的名字命名为“Ge”。锗是重要的半导体材料,其有机化合物在治疗癌症方面有着独特的功效。下图为工业上利用锗锌矿(主要成分GeO2和ZnS)来制备高纯度锗的流程。
已知:1.丹宁是一种有机沉淀剂,可与四价锗络合形成沉淀;2.GeCl4易水解,在浓盐酸中溶解度低。

(1)简述步骤①中提高酸浸效率的措施___________(写两种)。
(2)步骤②操作A方法是___________。
(3)步骤③中的物质在___________(填仪器名称)中加热。
(4)步骤④不能用稀盐酸,原因可能是___________。
(5)写出步骤⑤的化学方程式___________。写出步骤⑦的化学方程式___________。
(6)请写出一种证明步骤⑦反应完全的操作方法___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com