
【题目】苯乙酮是重要的化工原料,可由苯经下述反应制备:

实验步骤如下:

实验步骤如下:
步骤1:向如图所示的三颈烧瓶中迅速加入13g粉状无水AlCl3和16mL(14g,0.18mol)无水苯。在搅拌下将4mL(4.3g,0.04mol)乙酸酐自滴液漏斗慢慢滴加到三颈烧瓶中。加完后,待反应稍缓和后在沸水浴中搅拌回流,直到不再有HCl气体逸出为止。
步骤2:将反应混合物冷却到室温,在搅拌下倒入18mL浓盐酸和30g碎冰的烧杯中(在通风橱中进行),若仍有固体不溶物,可补加适量浓盐酸使之完全溶解。将混合物转入分液漏斗中,分出有机层,水层用苯萃取两次(每次8mL)。合并有机层,依次用15mL10%NaOH溶液、15mL水洗涤,再用无水MgSO4干燥。
步骤3:先在水浴上蒸馏回收物质A,然后在石棉网上加热蒸去残留的苯,稍冷后改用空气冷凝管蒸馏收集195~202℃馏分,产量约4.1g。
(1)步骤1中搅拌回流时,冷凝水从_____(填“a”或“b”)端进水,倒置漏斗的作用是_____。
(2)步骤2中水层用苯萃取两次(每次8mL),而不萃取一次(16mL)的目的是_____。用15mL10% NaOH溶液洗涤的目的是_____。
(3)步骤3中在水浴上蒸馏回收的物质A为_____。
(4)本次实验苯乙酮的产率为_____。
【答案】a 防止吸收HCl时产生倒吸现象 提高苯乙酮的萃取率 除去盐酸、醋酸等酸性物质 苯 85.4%
【解析】
(1)步骤1中搅拌回流时,冷凝水从a端进水,冷却效果好,氯化氢极易溶于水,倒置漏斗的作用是防止吸收HCl时产生倒吸现象;
(2)步骤2中水层用苯萃取两次(每次8mL),而不萃取一次(16mL)的目的是提高苯乙酮的萃取率,用15mL10% NaOH溶液洗涤的目的是除去盐酸、醋酸等酸性物质;
(3)由表中信息可知,苯的沸点最低,步骤3中在水浴上蒸馏回收的物质A为苯;
(4)产量约4.1g为实际苯乙酮的质量,理论上生成质量为0.04mol×120g/mol=4.8g,本次实验苯乙酮的产率为4.1g/4.8g×100%=85.4%。


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
【题目】实验室可利用SO2与Cl2在活性炭的催化下制取一种重要的有机合成试剂磺酰氯(SO2Cl2)。所用的反应装置如下图所示(部分夹持装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈的水解反应,遇潮湿空气会产生白雾。

(1)化合物SO2Cl2中S元素的化合价为__________。
(2)仪器D的名称是___________。
(3)乙、丙装置制取原料气Cl2与SO2。
①乙装置F中充满Cl2,则E中所盛放的溶液为_____________(填溶液的名称)。
②丙装置中试剂X、Y的组合最好是_____________。
A 98%浓硫酸+Cu B 70%H2SO4+Na2SO3 C 浓HNO3+Na2SO3
(4)上述装置的正确连接顺序为________、________、丁、_______、_________(用甲、乙、丙表示,可重复使用)。
(5)B装置中从a口通入冷水的作用是_________;C装置的作用是_______________。
(6)SO2Cl2遇水能发生剧烈的水解反应,会产生白雾,则SO2Cl2发生水解反应的化学方程式为________。
(7)若反应中消耗氯气的体积为1.12L(已转化为标准状况,SO2足量),最后通过蒸馏得到纯净的磺酰氯5.13g,则磺酰氯的产率为______________(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生反应2SO2(g) + O2(g) ![]() 2SO3(g);△H<0。下图是该反应化学反应速率随时间变化的图像,推断在t1时刻突然变化的条件可能是
2SO3(g);△H<0。下图是该反应化学反应速率随时间变化的图像,推断在t1时刻突然变化的条件可能是

A. 催化剂失效 B. 增大容器的体积
C. 降低体系温度 D. 减小生成物的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硫铁矿烧渣(主要成分Fe2O3、SiO2,少量的Fe3O4、Al2O3、MgO)生产安全高效的水处理剂高铁酸钾(K2FeO4)的工艺流程如下:

已知:FeO42﹣在强碱性溶液中稳定,但在Fe(OH)3催化作用下会发生分解。
(1)“酸浸”时加入硫酸的量不宜过多的原因是_____。
(2)“氧化”时发生反应的离子方程式为_____。
(3)在控制其他条件不变的情况下,探究保持Fe2(SO4)3和NaOH总质量不变,改变其质量比对K2FeO4产率的影响,实验结果如图所示,当质量比大于0.55时K2FeO4的产率下降的原因可能是_____。

(4)“过滤2”产生的滤渣的主要成分为_____(填化学式),“过滤3”所得滤液中含有的阴离子有OH﹣、Cl﹣、SO42﹣、_____、_____(填化学式)。
(5)K2FeO4可将水中的H2S氧化为硫酸盐,同时K2FeO4被还原为Fe(OH)3,则反应时K2FeO4与H2S的物质的量之比为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2在Fe2+、Cu2+的存在下生成具有强氧化性的OH(羟基自由基),OH可将有机物氧化降解。
(1)Cu2+H2O2体系中存在下列反应:
Cu2+(aq)+H2O2(aq)═CuOOH+(aq)+H+(aq)△H1=a kJmol﹣1
CuOOH+(aq)═Cu+(aq)+OH(aq)+1/2O2(g)△H2=b kJmol﹣1
2CuOOH+(aq)═2Cu+(aq)+H2O2(aq)+O2(g)△H3=c kJmol﹣1
则H2O2(aq)═2OH(aq)△H=_____kJmol﹣1。

(2)为探究温度对Cu2+H2O2甲基橙去除率的影响,某研究小组在不同温度下进行实验(其他条件相同),实验结果如图所示。相同条件下,温度升高,甲基橙去除速率增大,其原因是_____。
(3)为探究Fe2+Cu2+H2O2能够协同催化氧化降解甲基橙,某研究小组的实验结果如图所示。得出“Fe2+Cu2+H2O2催化氧化降解甲基橙效果优于单独加入Fe2+或Cu2+”结论的证据为_____。

实验条件:200 mL甲基橙模拟废水(1.5 gL﹣1,pH=3.0),温度60℃、V(H2O2)=2.0 mL
1﹣V(H2O2):m(FeSO4):m(CuSO4)=2:0.02:0.4
2﹣V(H2O2):m(FeSO4):m(CuSO4)=2:0.02:0
3﹣V(H2O2):m(FeSO4):m(CuSO4)=2:0:0.4
4﹣V(H2O2):m(FeSO4):m(CuSO4)=2:0:0
(4)EFH2O2FeOx法可用于水体中有机污染物降解,其反应机理如下图所示。阳极的电极反应式为_____,X微粒的化学式为_____,阴极附近Fe2+参与反应的离子方程式为_____。

(5)SCOD是指溶解性化学需氧量,是衡量水中有机物质含量多少的指标。水体SCOD越大,说明其有机物含量越高。用Fe2+H2O2法氧化破解啤酒工业污泥中的微生物,释放出有机物和氮等。测得不同初始pH下污泥经氧化破解后上层清液中的SCOD及总氮浓度如上图所示。当pH>2.5时,总氮浓度、SCOD均降低,其原因可能是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有几组物质的熔点(℃)的数据:
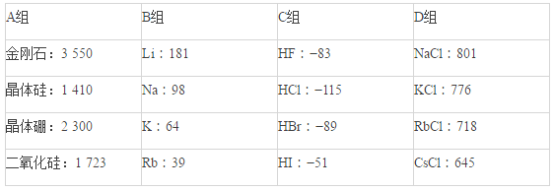
据此回答下列问题:
(1)A组属于___________晶体,其熔化时克服的微粒间的作用力是__________________。
(2)B组晶体共同的物理性质是___________________(填序号)。
①有金属光泽 ②导电性 ③导热性 ④延展性
(3)C组中HF熔点反常是由于_______________________________________。
(4)D组晶体可能具有的性质是_________________(填序号)。
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
(5)D组晶体的熔点由高到低的顺序为NaCl>KCl>RbCl>CsCl,其原因解释为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莫尔盐[(NH4)2Fe(SO4)26H2O,Mr=392]是一种重要的还原剂,在空气中比一般的亚铁盐稳定。某学习小组设计如下实验制备少量的莫尔盐并测定其纯度。

回答下列问题:
Ⅰ制取莫尔盐
(1)连接装置,检査装置气密性。将0.1mol(NH4)2SO4,晶体置于玻璃仪器中______(填仪器名称),将6.0g洁浄铁屑加人锥形瓶中。
(2)①打开分液漏斗瓶塞,关闭活塞K3,打开K2、K1,加完55.0mL2mol·L-1稀硫酸后关闭K1。A装置中反应的离子方程式为____
②待大部分铁粉溶解后,打开K3、关闭K2,此时可以看到的现象为_______,原因是_______
③关闭活塞K2、K3,采用100℃水浴蒸发B中水分,液面产生晶膜时,停止加热,冷却结晶、____、用无水乙醇洗涤晶体。该反应中硫酸需过量,保持溶液的pH在1~2之间,其目的为____
④装置C的作用为 ____,装置C存在的缺点是____
Ⅱ.测定莫尔盐样品的纯度
(3)称取所得莫尔盐样品10.0g,用煮沸后冷却的蒸馏水配成100mL溶液,取20.00mL溶液加人稀硫酸,用0.1molL-1的KMnO4溶液滴定,达到滴定终点时消耗10.00mlKMnO4溶液。滴定反应的离子方程式为____,该样品的纯度为____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在1×105 Pa、298 K条件下,2 mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是
A. H2(g)+![]() O2(g)===H2O(g) ΔH=+242 kJ·mol-1
O2(g)===H2O(g) ΔH=+242 kJ·mol-1
B. 2H2(g)+O2(g)===2H2O(l) ΔH=-484 kJ·mol-1
C. H2O(g)===H2(g)+![]() O2(g) ΔH=+242 kJ·mol-1
O2(g) ΔH=+242 kJ·mol-1
D. 2H2(g)+O2(g)===2H2O(g) ΔH=+484 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气排放的CO、NOx等气体是大气污染的主要来源,NOx也是雾天气的主要成因之一。
(1)科学家研究利用催化技术将尾气中有害的NO和CO转变成无毒的气体,其热化学方程式为:2CO(g)+2NO(g)![]() 2CO2(g)+N2(g) △H1=-746.5kJ·mol—1
2CO2(g)+N2(g) △H1=-746.5kJ·mol—1
已知:2C(s)+O2(g)![]() 2CO(g) △H2=-221.0kJmol—1
2CO(g) △H2=-221.0kJmol—1
CO2(g)![]() C(s)+O2(g) △H3=+393.5kJmol—1
C(s)+O2(g) △H3=+393.5kJmol—1
①C(s)的然烧热(△H)为_____________。
②NO(g)分解成两种气体单质的热化学方程式为_____________。
(2)一定温度下,向初始容积均为2L的A、B、C三个容器中,均投入5 mol CO气体和4 mol NO气体发生如下反应:2CO(g)+2NO(g) ![]() 2CO2(g)+N2(g)
2CO2(g)+N2(g)

①上图表示该反应中NO的平衡转化率(![]() )随温度、压强变化的示意图,则X代表的物理量是______,Y1_ Yz(填“>”或“<”)
)随温度、压强变化的示意图,则X代表的物理量是______,Y1_ Yz(填“>”或“<”)
②反应过程中,A容器中保持恒温恒压,B容器中保持恒温恒容,C容器中保持绝热恒容。下列说法错误的是________。
a.B、C两个容器中反应达到平衡所用的时长为:tB>tC
b.3个容器中NO的平衡转化率的大小顺序为![]() >
>![]() >
>![]()
c.当A容器内气体平均摩尔质量不变时,说明该反应处于化学平衡状态
d.当B容器内气体密度保持不变时,说明该反应处于化学平衡状态
③当B容器中保持平衡时,NO所占体积分数为25%。则相同温度下,A容器中逆反应的平衡常数K=_________(保留两位有效数字)
(3)利用反应NO2+NH3→N2+H2O(未配平)消除用电器NO2的简易装置如图所示。

①a电极上的反应式为_____________。
②常温下,若用该电池电解0.6L,饱和食盐水,一段时间后,测得饱和食盐水pH变为13,则理论上b电极上消耗B气体的体积为_______mL(标准状况;假设电解过程中溶液体积不变)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com