
【题目】在密闭容器中发生反应2SO2(g) + O2(g) ![]() 2SO3(g);△H<0。下图是该反应化学反应速率随时间变化的图像,推断在t1时刻突然变化的条件可能是
2SO3(g);△H<0。下图是该反应化学反应速率随时间变化的图像,推断在t1时刻突然变化的条件可能是

A. 催化剂失效 B. 增大容器的体积
C. 降低体系温度 D. 减小生成物的浓度
【答案】C
【解析】
分析图象可知,0~t1时间段是建立平衡的过程,t1时反应处于平衡状态,t1时改变条件后正、逆反应速率都减小,因为正反应速率大于逆反应速率,所以平衡向正反应方向移动,结合温度、压强、浓度、催化剂对反应速率和平衡的影响来分析。
A.由图象可知t1改变条件后正反应速率大于逆反应速率,说明该反应向正反应方向移动,但催化剂不能使平衡移动,与图象不符,A项错误;
B.增大容器的体积时反应物和生成物浓度都减小,正反应速率和逆反应速率都要减小,增大容器的体积即减小压强,根据平衡移动原理可知减压使该平衡向逆反应方向移动,则逆反应速率大于正反应速率,与图象不符,B项错误;
C.降低体系温度时正反应速率和逆反应速率都减小,根据平衡移动原理可知降温使该平衡向正反应方向移动,则正反应速率大于逆反应速率,与图象相符,C项正确;
D.在减小生成物浓度的瞬间逆反应速率减小,而正反应速率不变,与图象不相符,D项错误;答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】化合物F是合成一种天然茋类化合物的重要中间体,其合成路线如下:

(1)A中含氧官能团的名称为________和________。
(2)A→B的反应类型为________。
(3)C→D的反应中有副产物X(分子式为C12H15O6Br)生成,写出X的结构简式:________。
(4)C的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:________。
①能与FeCl3溶液发生显色反应;
②碱性水解后酸化,含苯环的产物分子中不同化学环境的氢原子数目比为1∶1。
(5)已知: (R表示烃基,R'和R"表示烃基或氢),写出以
(R表示烃基,R'和R"表示烃基或氢),写出以 和CH3CH2CH2OH为原料制备
和CH3CH2CH2OH为原料制备 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。________________________
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国内某科技研究小组首次提出一种新型的Li+电池体系,该体系征集采用含有I-、Li+的水溶液,负极采用固体有机聚合物,电解质溶液采用LiNO3溶液,聚合物离子交换膜作为隔膜将液态正极和固态负极分隔开(原理示意图如图)。已知:I-+I2=I3-,则下列有关判断正确的是

A. 图甲是原电池工作原理图,图乙是电池充电原理图
B. 放电时,正极液态电解质溶液的颜色变浅
C. 充电时,Li+从右向左通过聚合物离子交换膜
D. 放电时,负极的电极反应式为:

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色气体N2O4是一种强氧化剂,为重要的火箭推进剂之一。N2O4与NO2转换的热化学方程式为N2O4(g)![]() 2NO2(g) ΔH=+24.4 kJ/mol。
2NO2(g) ΔH=+24.4 kJ/mol。
(1)将一定量N2O4投入固定容积的真空容器中,下述现象能说明反应达到平衡的是 _________。
a.v正(N2O4)=2v逆(NO2)
b.体系颜色不变
c.气体平均相对分子质量不变
d.气体密度不变
达到平衡后,保持体积不变升高温度,再次到达平衡时,混合气体颜色____(填 “变深”“变浅”或“不变”),判断理由_______。
(2)平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数[例如:p(NO2)=p总×x(NO2)]。写出上述反应平衡常数Kp表达式 _______________________(用p总、各气体物质的量分数x表示);影响Kp的因素_________________。
(3)上述反应中,正反应速率v正=k正·p(N2O4),逆反应速率v逆=k逆·p2(NO2),其中k正、k逆为速率常数,则Kp为____(以k正、k逆表示)。若将一定量N2O4投入真空容器中恒温恒压分解(温度298 K、压强100 kPa),已知该条件下k正=4.8×104 s-1,当N2O4分解10%时,v正=______________kPa·s-1。
(4)真空密闭容器中放入一定量N2O4,维持总压强p0恒定,在温度为T时,平衡时N2O4分解百分率为α。保持温度不变,向密闭容器中充入等量N2O4,维持总压强在2p0条件下分解,则N2O4的平衡分解率的表达式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A2(g) + 2B2(g) ![]() 2AB2(g) △H<0,下列说法正确的是
2AB2(g) △H<0,下列说法正确的是
A. 升高温度,正反应速率增加,逆反应速率减小
B. 增大压强能使正、逆反应速率都增大,但有利于平衡正向移动
C. 达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D. 达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室用食盐晶体与浓硫酸在微热条件下反应制取氯化氢气体,反应的化学方程式为_____.
(2)氯化氢气体的发生装置应该选择装置_____(填装置的编号,下同).由于氯化氢气体有毒,所以实验室用装置D来收集氯化氢,则收集氯化氢时,气体从_____管(填a或b)进入.用水吸收多余的氯化氢气体时,应该选择装置_____,这是为了防止_____.

(3)要得到干燥的氯化氢气体,还需要在制取和收集装置之间插入一个干燥装置D,此时D中装入的液体应该是_____.
(4)为了比较盐酸溶液与氯化氢气体性质的不同之处,取两支试管,一支滴入2~3mL盐酸,另一支收集干燥的氯化氢气体并塞好橡皮塞,然后各放入一片干燥的蓝色石蕊试纸.观察到的现象是_____.再取两支试管,一支滴入2~3mL盐酸,另一支收集干燥的氯化氢气体并塞好橡皮塞,然后各放入一小块锌片.观察到的现象是_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.5mol·L-1的NaHCO3溶液中滴入酚酞,溶液变红。试回答有关问题:
(1)该溶液中HCO3-的电离程度__________(填“大于”、“小于”或“等于”)HCO3-的水解程度。溶液中Na+、HCO3-、CO32-、H+、OH-离子的浓度由大到小的顺序为______________。
(2)某温度下纯水中的c(H+)= 2×10-7mol/L,则此时溶液中的c(OH-)=_________;若温度不变,滴入稀盐酸,使c(H+)= 5×10-4mol/L,则溶液中c(OH-)=____________,此时溶液中由水电离产生的c(H+)= _________ 。
(3)物质的量浓度均为0.1 mol/L的下列溶液:①KNO3、②Na2CO3、③NaHCO3、④HCl 、⑤CH3COOH、⑥NaOH 、⑦Ba(OH)2、⑧NH4Cl, pH 由大到小的顺序为________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙酮是重要的化工原料,可由苯经下述反应制备:

实验步骤如下:

实验步骤如下:
步骤1:向如图所示的三颈烧瓶中迅速加入13g粉状无水AlCl3和16mL(14g,0.18mol)无水苯。在搅拌下将4mL(4.3g,0.04mol)乙酸酐自滴液漏斗慢慢滴加到三颈烧瓶中。加完后,待反应稍缓和后在沸水浴中搅拌回流,直到不再有HCl气体逸出为止。
步骤2:将反应混合物冷却到室温,在搅拌下倒入18mL浓盐酸和30g碎冰的烧杯中(在通风橱中进行),若仍有固体不溶物,可补加适量浓盐酸使之完全溶解。将混合物转入分液漏斗中,分出有机层,水层用苯萃取两次(每次8mL)。合并有机层,依次用15mL10%NaOH溶液、15mL水洗涤,再用无水MgSO4干燥。
步骤3:先在水浴上蒸馏回收物质A,然后在石棉网上加热蒸去残留的苯,稍冷后改用空气冷凝管蒸馏收集195~202℃馏分,产量约4.1g。
(1)步骤1中搅拌回流时,冷凝水从_____(填“a”或“b”)端进水,倒置漏斗的作用是_____。
(2)步骤2中水层用苯萃取两次(每次8mL),而不萃取一次(16mL)的目的是_____。用15mL10% NaOH溶液洗涤的目的是_____。
(3)步骤3中在水浴上蒸馏回收的物质A为_____。
(4)本次实验苯乙酮的产率为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在某密闭容器中进行如下反应:
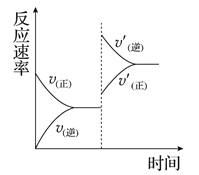
mA(g)+nB(g)![]() pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,
pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,
反应速率随时间的变化过程如图所示,则对该反应的叙述正确的是( )
A. 正反应是吸热反应 B. 逆反应是放热反应
C. m+n<p+q D. m+n>p+q
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com