
【题目】(1)实验室用食盐晶体与浓硫酸在微热条件下反应制取氯化氢气体,反应的化学方程式为_____.
(2)氯化氢气体的发生装置应该选择装置_____(填装置的编号,下同).由于氯化氢气体有毒,所以实验室用装置D来收集氯化氢,则收集氯化氢时,气体从_____管(填a或b)进入.用水吸收多余的氯化氢气体时,应该选择装置_____,这是为了防止_____.

(3)要得到干燥的氯化氢气体,还需要在制取和收集装置之间插入一个干燥装置D,此时D中装入的液体应该是_____.
(4)为了比较盐酸溶液与氯化氢气体性质的不同之处,取两支试管,一支滴入2~3mL盐酸,另一支收集干燥的氯化氢气体并塞好橡皮塞,然后各放入一片干燥的蓝色石蕊试纸.观察到的现象是_____.再取两支试管,一支滴入2~3mL盐酸,另一支收集干燥的氯化氢气体并塞好橡皮塞,然后各放入一小块锌片.观察到的现象是_____.
【答案】NaCl(s)+H2SO4(浓)![]() NaHSO4+HCl↑ B a F 水倒吸入集气瓶 浓硫酸 盐酸中石蕊试纸变红,干燥氯化氢中试纸不变色 盐酸中锌片溶解,有气泡产生,氯化氢中锌片无变化
NaHSO4+HCl↑ B a F 水倒吸入集气瓶 浓硫酸 盐酸中石蕊试纸变红,干燥氯化氢中试纸不变色 盐酸中锌片溶解,有气泡产生,氯化氢中锌片无变化
【解析】
(1)用食盐晶体与浓硫酸在微热条件下反应生成氯化氢气体和硫酸氢钠;
(2)实验室利用食盐晶体和浓硫酸加热反应制备氯化氢,属于固体+液体![]() 气体的反应,据此选择发生装置;氯化氢是比空气重的极易溶于水的气体,据此选择收集和尾气吸收装置;
气体的反应,据此选择发生装置;氯化氢是比空气重的极易溶于水的气体,据此选择收集和尾气吸收装置;
(3)用装置D干燥气体需要选择液体干燥剂,结合氯化氢的性质分析判断;
(4)盐酸是氯化氢气体的水溶液,氯化氢电离出氢离子,溶液显酸性,干燥的氯化氢是氯化氢分子,无氢离子,据此分析解答。
(1)实验室用食盐晶体与浓硫酸在微热条件下反应制取氯化氢气体,反应的化学方程式为NaCl(s)+H2SO4(浓)![]() NaHSO4+HCl↑,故答案为:NaCl(s)+H2SO4(浓)
NaHSO4+HCl↑,故答案为:NaCl(s)+H2SO4(浓)![]() NaHSO4+HCl↑;
NaHSO4+HCl↑;
(2)实验室利用食盐晶体和浓硫酸加热反应制备的,属于固体+液体![]() 气体,发生装置选择装置B;氯化氢是比空气重的极易溶于水的气体,需要用向上排气法收集,导气管长进短出,选择装置D收集氯化氢,应从a处进,多余的氯化氢气体可以用水吸收,但要防止倒吸,应选择装置F吸收多余的氯化氢,故答案为:B;a;F;水倒吸入集气瓶;
气体,发生装置选择装置B;氯化氢是比空气重的极易溶于水的气体,需要用向上排气法收集,导气管长进短出,选择装置D收集氯化氢,应从a处进,多余的氯化氢气体可以用水吸收,但要防止倒吸,应选择装置F吸收多余的氯化氢,故答案为:B;a;F;水倒吸入集气瓶;
(3)用装置D干燥氯化氢气体,是利用洗气原理,应选择液体干燥剂,能用于干燥氯化氢气体的干燥剂可以选择浓硫酸,故答案为:浓硫酸;
(4)盐酸是氯化氢气体的水溶液,氯化氢电离出氢离子,溶液显酸性,干燥的氯化氢是氯化氢分子,不能电离出氢离子,各放入一片干燥的蓝色石蕊试纸,盐酸溶液中石蕊试纸变红色,干燥的氯化氢气体中试纸无变化,各放入一小块锌片,盐酸中锌片溶解,反应生成氢气,氯化氢气体中无变化,故答案为:盐酸中石蕊试纸变红,干燥氯化氢中试纸不变色;盐酸中锌片溶解,有气泡产生,氯化氢中锌片无变化。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】A.[物质结构与性质]
Cu2O广泛应用于太阳能电池领域。以CuSO4、NaOH和抗坏血酸为原料,可制备CuO。
(1)Cu2+基态核外电子排布式为____。
(2)![]() 的空间构型为____(用文字描述);Cu2+与OH反应能生成[Cu(OH)4]2,[Cu(OH)4]2中的配位原子为____(填元素符号)。
的空间构型为____(用文字描述);Cu2+与OH反应能生成[Cu(OH)4]2,[Cu(OH)4]2中的配位原子为____(填元素符号)。
(3)抗坏血酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为____;推测抗坏血酸在水中的溶解性:____(填“难溶于水”或“易溶于水”)。

(4)一个Cu2O晶胞(见图2)中,Cu原子的数目为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸铁锂电池是新型的绿色能源电池,其简化的生产工艺流程如下。
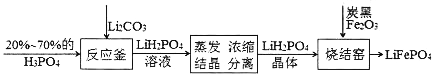
(1)反应釜中反应的化学方程式为_______,该反应体现出非金属性关系:P_____C(填“>”或“<”)。
(2)室温下,LiH2PO4溶液的pH随c(H2PO4-)的变化如图1所示,H3PO4溶液中H2PO4-的分布分数![]() 随pH的变化如图2所示[
随pH的变化如图2所示[![]() (含P元素的粒子)]。
(含P元素的粒子)]。
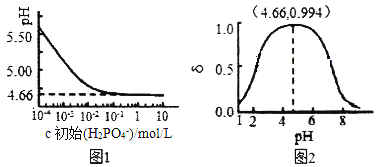
①由图1知,低浓度时LiH2PO4溶液的pH小于7,且随着c初始(H2PO4-)的增大而减小,其合理的解释为__________________。
②综合上图分析,若用浓度大于1mol/L的H3PO4溶液溶解Li2CO3,要使反应釜中的H3PO4几乎全部转化成LiH2PO4,反应釜中需要控制溶液的pH=________。
(3)磷酸铁锂电池总反应为:LiFePO4+6C![]() Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。充电时,Li+移向______(填“阳极”或“阴极”);放电时,正极反应式为__________________。
Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。充电时,Li+移向______(填“阳极”或“阴极”);放电时,正极反应式为__________________。
(4)磷酸铁锂电池中铁的含量可通过如下方法测定:称取1.60g试样用盐酸溶解,在溶液中加入稍过量的SnCl2溶液,再加入HgCl2饱和溶液,用二苯胺磺酸钠作指示剂,用0.030mol/L重铬酸钾溶液滴定至溶液由浅绿色变为蓝紫色,消耗重铬酸钾溶液50.00mL。
已知:2Fe3++Sn2++6Cl-=SnCl62-+2Fe2+
4Cl-+Sn2++2HgCl2=SnCl62-+Hg2Cl2
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
①实验中加入HgCl2饱和溶液的目的是____________。
②铁的百分含量Fe(%)=_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是
A. HCl和NaOH反应的中和热△H=-57.3 kJ·mol1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ·mol1
B. 甲烷的标准燃烧热ΔH=-890.3 kJ·mol1,则CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH<-890.3 kJ·mol1
C. 已知:500℃、30MPa下,N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4kJ·mol-1;将1.5 mol H2和过量的N2在此条件下充分反应,放出热量46.2 kJ
2NH3(g) ΔH=-92.4kJ·mol-1;将1.5 mol H2和过量的N2在此条件下充分反应,放出热量46.2 kJ
D. CO(g)的燃烧热是283.0kJ·mol1,则2CO2(g) ===2CO(g)+O2(g)反应的△H=+566.0 kJ·mol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生反应2SO2(g) + O2(g) ![]() 2SO3(g);△H<0。下图是该反应化学反应速率随时间变化的图像,推断在t1时刻突然变化的条件可能是
2SO3(g);△H<0。下图是该反应化学反应速率随时间变化的图像,推断在t1时刻突然变化的条件可能是

A. 催化剂失效 B. 增大容器的体积
C. 降低体系温度 D. 减小生成物的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4)是一种二元弱酸。常温下,向H2C2O4溶液中逐滴加入NaOH溶液,混合溶液中lgX[X为c(HC2O4-)/c(H2C2O4)或c(C2O42-)/c(HC2O4-)]与pH的变化关系如图所示。下列说法一定正确的是( )

A. Ⅰ表示lgc(HC2O4-)/c(H2C2O4)与pH的变化关系
B. pH=1.22的溶液中:2c(C2O42﹣)+c(HC2O4﹣)>c(Na+)
C. 1.22<pH<4.19的溶液中:c(HC2O4﹣)>c(C2O42﹣)>c(H2C2O4)
D. pH=4.19的溶液中:c(Na+)=3c(HC2O4﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硫铁矿烧渣(主要成分Fe2O3、SiO2,少量的Fe3O4、Al2O3、MgO)生产安全高效的水处理剂高铁酸钾(K2FeO4)的工艺流程如下:

已知:FeO42﹣在强碱性溶液中稳定,但在Fe(OH)3催化作用下会发生分解。
(1)“酸浸”时加入硫酸的量不宜过多的原因是_____。
(2)“氧化”时发生反应的离子方程式为_____。
(3)在控制其他条件不变的情况下,探究保持Fe2(SO4)3和NaOH总质量不变,改变其质量比对K2FeO4产率的影响,实验结果如图所示,当质量比大于0.55时K2FeO4的产率下降的原因可能是_____。

(4)“过滤2”产生的滤渣的主要成分为_____(填化学式),“过滤3”所得滤液中含有的阴离子有OH﹣、Cl﹣、SO42﹣、_____、_____(填化学式)。
(5)K2FeO4可将水中的H2S氧化为硫酸盐,同时K2FeO4被还原为Fe(OH)3,则反应时K2FeO4与H2S的物质的量之比为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有几组物质的熔点(℃)的数据:
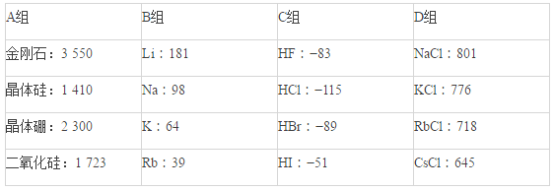
据此回答下列问题:
(1)A组属于___________晶体,其熔化时克服的微粒间的作用力是__________________。
(2)B组晶体共同的物理性质是___________________(填序号)。
①有金属光泽 ②导电性 ③导热性 ④延展性
(3)C组中HF熔点反常是由于_______________________________________。
(4)D组晶体可能具有的性质是_________________(填序号)。
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
(5)D组晶体的熔点由高到低的顺序为NaCl>KCl>RbCl>CsCl,其原因解释为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用CO和H2在催化剂的作用下合成甲醇,发生的反应如下:CO(g)+2H2(g)![]() CH3OH(g),在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是
CH3OH(g),在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是

A. 该反应的△H<0,且p1<p2
B. 反应速率:ν逆(状态A)>ν逆(状态B)
C. 在C点时,CO转化率为75%
D. 在恒温恒压条件下向密闭容器中充入不同量的CH3OH,达平衡时CH3OH的体积分数也不同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com