
【题目】下列说法中,正确的是
A.Fe、Fe2O3都能与稀盐酸反应,都属于置换反应
B.CaO、NaOH固体都能与水反应,都能作干燥剂
C.浓盐酸、浓硫酸都有挥发性,敞口放置浓度都会变小
D.NH4Cl、(NH4)2SO4都含有NH4+,都能与熟石灰反应生成NH3
科目:高中化学 来源: 题型:
【题目】某课外小组欲鉴定某硫酸钠样品中是否含有亚硫酸钠,设计方案如下:取少量固体配成溶液,往溶液中滴加少量酸性KMnO4溶液,观察溶液是否褪色。

如果溶液紫色褪去,说明该样品中含有亚硫酸钠。
(1)用离子方程式表示该反应原理: 。
(2)图I表示100mL量筒中液面的位置,A与B,B与C刻度间相差10mL,如果刻度A为30,量筒中液体的体积是____________mL。图II表示25mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填字母)________________。
A.等于amL B.等于(25-a)mL C.大于amL D.大于(25-a)mL
(3)该小组同学欲测定样品中亚硫酸钠的含量,操作步骤如下:
a.称取mg样品,用蒸馏水溶解并置于锥形瓶中
b.将V1mL C1mol/L的酸性KMnO4溶液(过量)倒入锥形瓶中振荡
c.用C2mol/L草酸钠(Na2C2O4)溶液滴定过量的KMnO4,至滴定终点时用去Na2C2O4溶液V2mL
①KMnO4溶液应装在_________式滴定管中,达到滴定终点时溶液颜色的变化 。
②样品中Na2SO3的物质的量为 mol。(用含C1 、V1 、C2、 V2的代数式表示)。
(4)下列操作会导致测得的Na2SO3的物质的量偏高的是 (填字母,双选)。
A.未用Na2C2O4标准液润洗滴定管
B.滴定前仰视盛有Na2C2O4溶液的滴定管,滴定后俯视
C.滴定前滴定管尖嘴处有气泡,滴定后消失
D.滴定时摇动锥形瓶,瓶中的液滴溅出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式或离子方程式中,正确的是:
A. 甲烷的标准燃烧热为890.3 kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H="-890.3" kJ/mol
B. CO(g)的燃烧热是283.0 kJ/mol ,则2CO2(g)=2CO(g)+O2(g)的反应热△H="+2×283.0" kJ/mol
C. NaOH和HCl反应的中和热 △H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol
D. 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6kJ/mol
2NH3(g) △H=-38.6kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为2 L的密闭容器中,充入6mol N2,10mol H2,发生反应:N2(g)+3 H2(g) ![]() 2NH3(g)反应进行5 min时,测得NH3的浓度为1mol·L-1,在此时间内,下列反应速率表示正确的是
2NH3(g)反应进行5 min时,测得NH3的浓度为1mol·L-1,在此时间内,下列反应速率表示正确的是
A.v(NH3)=0.1mol·L-1·min-1 B.v(H2)=0.7 mol·L-1·min-1
C.v(NH3)=0.2mol·L-1·min-1 D.v(H2)=0.5mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D均为短周期元素。A、B可形成两种液态化合物甲和乙,其最简式分别为BA和B2A。A与D可形成气态化合物DA、DA2。B与D可形成一种极易溶于水的碱性气体X。B与C可形成极易溶于水的酸性气体Y。Y溶于水能完全电离。已知X分子与乙分子中的电子数相等,Y分子与甲分子中的电子数相等。请回答:
(1)甲的电子式为___________。
(2)常温下,aL pH为2的Y溶液与bL pH为12的氢氧化钠溶液混合后,所得溶液pH=3,则a:b=___________。
(3)X溶于水后发生电离,写出电离方程式____________,已知X在液态时和水一样,可发生微弱的电离,产生两种含相同电子数的粒子。请写出它的电离方程式:___________。
(4)X与甲在一定条件下可发生反应,生成无污染的产物,写出反应的化学方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将氨水缓缓地滴入盐酸中至中性,下列有关的说法:①盐酸过量 ②氨水过量 ③恰好完全反应 ④c(NH4+)=c(Cl-) ⑤c(NH4+)<c(Cl-)正确的是( )
A. ①⑤ B. ③④ C. ②⑤ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4种相邻主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性。
m | n | ||
x | y |
回答下列问题:
(1)元素x在周期表中的位置是 ,其单质可采用电解熔融 的方法制备。
(2)气体分子(mn)2的电子式为 ,(mn)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为 。
(3)已知氰化钠(NaCN),可以与很多金属形成络合物,因此工业上采用氰化法提炼金:用稀的氰化钠溶液处理粉碎了的金矿石,通入空气,使金矿石中的金粒溶解,生成能溶于水的络合物Na[Au(CN)2],其反应方程式为:①4Au+8NaCN+2H2O+O2=4Na[Au(CN)2]+4NaOH,Na[Au(CN)2]在水溶液中的电离方程式为:②Na[Au(CN)2]=Na++[Au(CN)2]-,然后再用锌从溶液中把金置换出来,锌转化为Na2[Zn(CN)4]。据此,请利用①写出在空气中用氰化钠溶液提取金的电极反应式:正极: ,负极: 。
(4)若人不慎氰化钠中毒,可用Na2S2O3缓解,二者反应得到两种含硫元素的离子,其中一种遇到Fe3+可变为红色。写出解毒原理的相关离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1mol/L的CH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+,对于该平衡,下列叙述正确的是( )
CH3COO-+H+,对于该平衡,下列叙述正确的是( )
A.加入少量NaOH固体,平衡向正反应方向移动,溶液中c(H+)增大
B.加水,平衡向正反应方向移动,c(CH3COO-)和c(H+)增大
C.加入少量HCl,平衡逆向移动,溶液中c(H+)减少
D.加入少量CH3COONa固体,平衡向逆反应方向移动,溶液导电能力增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各情况,在其中Fe片腐蚀由快到慢的顺序是( )
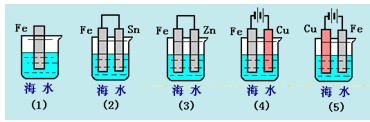
A.(5)(2)(1)(3)(4) B.(2)(5)(3)(4)(1)
C.(5)(3)(4)(1)(2) D.(1)(5)(3)(4)(2)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com