
【题目】A、B、C、D均为短周期元素。A、B可形成两种液态化合物甲和乙,其最简式分别为BA和B2A。A与D可形成气态化合物DA、DA2。B与D可形成一种极易溶于水的碱性气体X。B与C可形成极易溶于水的酸性气体Y。Y溶于水能完全电离。已知X分子与乙分子中的电子数相等,Y分子与甲分子中的电子数相等。请回答:
(1)甲的电子式为___________。
(2)常温下,aL pH为2的Y溶液与bL pH为12的氢氧化钠溶液混合后,所得溶液pH=3,则a:b=___________。
(3)X溶于水后发生电离,写出电离方程式____________,已知X在液态时和水一样,可发生微弱的电离,产生两种含相同电子数的粒子。请写出它的电离方程式:___________。
(4)X与甲在一定条件下可发生反应,生成无污染的产物,写出反应的化学方程式_________。
【答案】(1)![]() ;(2)11:9;
;(2)11:9;
(3)NH3·H2O![]() NH4++OH-;2NH3
NH4++OH-;2NH3![]() NH4++NH2-;
NH4++NH2-;
(4)2NH3+3H2O2![]() N2+6H2O
N2+6H2O
【解析】试题分析:A、B、C、D四种元素,由A、B可形成两种液态化合物,其最简式分别为BA和B2A,从A和B形成的化合物B2A,可知B的化合价为+1,A的化合价为-2,从而得出A为ⅥA 族元素,再从它能与B形成两种化合物可以确定,A只能为氧元素,B为氢元素;由B与D可形成一种极易溶于水的碱性气体X,中学阶段碱性气体只有氨气,故X为NH3,可知D为N元素;A、B、D可组成离子化合物,该晶体化学式为B4A3D2,其水溶液呈弱酸性,为NH4NO3;BA型液态化合物分子为H2O2,分子含有18个电子,B与C可形成极易溶于水的酸性气体Y,Y分子与BA型液态化合物分子中的电子数相等,故Y为HCl,C为Cl元素。
(1)甲为双氧水,电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(2) pH=12的NaOH溶液中c(OH-)=![]() mol/L=0.01mol/L,pH=2的HCl溶液中c(H+)=0.01mol/L,若所得混合溶液的pH=3,即混合后溶液显酸性,则混合溶液中c(H+)=
mol/L=0.01mol/L,pH=2的HCl溶液中c(H+)=0.01mol/L,若所得混合溶液的pH=3,即混合后溶液显酸性,则混合溶液中c(H+)=![]() =0.001mol/L,解得a:b=11:9,故答案为:11:9;
=0.001mol/L,解得a:b=11:9,故答案为:11:9;
(3) X为NH3,NH3溶于水后发生电离,电离方程式为NH3·H2O![]() NH4++OH-,已知NH3在液态时和水一样,可发生微弱的电离,产生两种含相同电子数的粒子。电离方程式为2NH3
NH4++OH-,已知NH3在液态时和水一样,可发生微弱的电离,产生两种含相同电子数的粒子。电离方程式为2NH3![]() NH4++NH2-,故答案为:NH3·H2O
NH4++NH2-,故答案为:NH3·H2O![]() NH4++OH-;2NH3
NH4++OH-;2NH3![]() NH4++NH2-;
NH4++NH2-;
(4)NH3与H2O2在一定条件下可发生反应,生成无污染的产物水和氮气,反应的化学方程式为2NH3+3H2O2![]() N2+6H2O,故答案为:2NH3+3H2O2
N2+6H2O,故答案为:2NH3+3H2O2![]() N2+6H2O。
N2+6H2O。


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:
【题目】某工厂的工业废水中含有大量的Fe2+、Cu2+、SO42-和Na+,为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁及金属铜,请根据下列流程在标有①﹣⑤的方框和括号内填写物质名称或操作方法,完成回收硫酸亚铁及金属铜的简单实验方案。

请完成流程图空白:
① 。② 。
③ 和 。④ 。
⑤ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究氨气及铵盐性质的过程中,下列根据实验现象得出的结论不正确的是
A.将集有氨气的试管倒扣于水槽中,液体迅速充满试管,说明氨气极易溶于水
B.将湿润的红色石蕊试纸放入集有氨气的集气瓶中,试纸由红色变为蓝色,说明氨水呈碱性
C.加热NH4HCO3固体,观察到固体逐渐减少,试管口有液滴产生,说明NH4HCO3受热不稳定
D.将红热的pt丝伸入如图所示的锥形瓶中,瓶口出现少量红棕色气体,说明氧气的直接氧化产物为NO2

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据原子结构及元素周期律的知识,下列推断正确的是( )
A. 3517Cl2与3717Cl2氧化能力相近,二者互为同位素
B. 过氧化氢的电子式:![]()
C. 同主族元素形成的含氧酸的酸性随核电荷数的增加而减弱
D. 同周期主族元素原子半径随核电荷数的增大而减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铂电极电解下列溶液时,阴极和阳极上的主要产物分别为H2和O2的是 ( )
A. 稀HCl溶液 B. 稀Na2SO4溶液 C. CuCl2溶液 D. AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是
A.Fe、Fe2O3都能与稀盐酸反应,都属于置换反应
B.CaO、NaOH固体都能与水反应,都能作干燥剂
C.浓盐酸、浓硫酸都有挥发性,敞口放置浓度都会变小
D.NH4Cl、(NH4)2SO4都含有NH4+,都能与熟石灰反应生成NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产中产生的废气、废液、废渣直接排放会造成污染,很多都经过吸收转化为化工产品。
I.利用电化学原理吸收工业生产中产生的SO2、NO,同时获得Na2S2O4和NH4NO3产品的工艺流程图如图(Ce为铈元素)。

请回答下列问题:
(1)装置Ⅱ中NO在酸性条件下生成NO2-的离子方程式: 。
(2)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示:
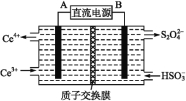
右侧反应室中发生的主要电极反应式为 。
(3)已知进入装置Ⅳ的溶液中NO2-的浓度为0.4 mol·L-1,要使1 m3该溶液中的NO2-完全转化为 NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2的体积为 L。
II.以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如下:
![]()
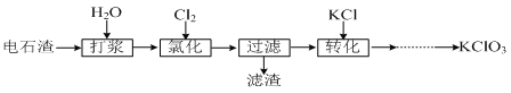
(4)氯化过程控制电石渣过量,在75℃左右进行。氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2,少量Ca(ClO)2 分解为CaCl2和O2。提高Cl2转化为Ca(ClO3)2的转化率的可行措施有 (填序号)。
A.适当减缓通入Cl2速率 B.充分搅拌浆料 C.加水使Ca(OH)2完全溶解
(5)氯化过程中Cl2 转化为Ca(ClO3)2的总反应方程式为
6Ca(OH)2+6Cl2===Ca(ClO3)2+5CaCl2+6H2O
氯化完成后过滤。滤渣的主要成分为 (填化学式)。
(6)向滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为KClO3,若溶液中KClO3的含量为100gL1,从该溶液中尽可能多地析出KClO3固体的方法是 。

(7)工业上常用磷精矿[Ca5(PO4)3F]和硫酸反应制备磷酸。已知25℃,101kPa时:
CaO(s)+H2SO4(l)=CaSO4(s)+H2O(l) △H=-271kJ/mol
5CaO(s)+H3PO4(l)+HF(g)=Ca5(PO4)3F(s)+5H2O(l) △H=-937kJ/mol
则Ca5(PO4)3F和硫酸反应生成磷酸的热化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)写出下列仪器的名称:
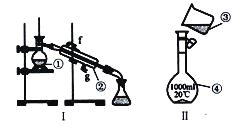
①__________________;②__________________;④__________________;
(2)仪器①~④中,使用时必须检査是否漏水的有_______________(填序号〉
(3)现需配制250 mL0.2mol/LNaCl溶液,装置II是某同学转移溶液的示意图,图中两处错误是_____________,___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程不用熵判据判断的是
A.氯化铵与结晶氢氧化钡混合研磨,很快会闻到刺激性气味
B.冬天一杯热水很快变冷
C.有序排列的火柴散落时成为无序排列
D.多次洗牌以后,扑克牌毫无规律的混乱排列的几率大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com