
【题目】孔雀石的主要成分是Cu2(OH)2CO3(含Fe2O3、FeCO3、Al2O3、SiO2杂质),工业上用孔雀石制备硫酸铜的第一步需用过量的硫酸溶解并过滤常温下,分别取滤液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是
A.加入过量氨水:Fe3+、![]() 、
、![]() 、OH-
、OH-
B.加入过量NaOH溶液:Na+、[Al(OH)4]-、![]() 、OH-
、OH-
C.加入过量H2O2溶液:Fe2+、H+、![]() 、Cu2+
、Cu2+
D.加入过量 NaHCO3溶液:Na+、Al3+、![]() 、
、![]()
【答案】B
【解析】
孔雀石的主要成分是Cu2(OH)2CO3(含Fe2O3、FeCO3、Al2O3、SiO2杂质),加入过量硫酸溶解后过滤,SiO2不反应,则滤液中含有的离子为:Cu2+、Fe3+、Fe2+、Al3+、SO42-、H+;
A.加入过量氨水后,Fe3+与氨水反应生成氢氧化铁沉淀,反应后溶液中不会大量存在Fe3+,故A错误;
B.加入过量NaOH溶液后,Cu2+、Fe3+、Fe2+反应生成难溶物,Al3+反应生成[Al(OH)4]-,所以反应后溶液中存在离子为Na+、[Al(OH)4]-、SO42-、OH-,故B正确;
C.H2O2具有强氧化性,Fe2+有还原性,H2O2能够氧化Fe2+变为Fe3+,反应后溶液中不会大量存在Fe2+,故C错误;
D.加入过量 NaHCO3溶液,Al3+、HCO3-之间发生双水解反应生成氢氧化铝沉淀和二氧化碳气体,所以反应后溶液中不会大量存在Al3+,故D错误;
答案为B。


科目:高中化学 来源: 题型:
【题目】高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价,如图所示为超氧化钾晶体的一个晶胞,则下列说法正确的是
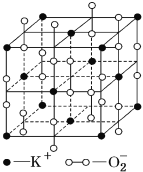
A. 超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个![]()
B. 晶体中每个K+周围有8个![]() ,每个
,每个![]() 周围有8个K+
周围有8个K+
C. 晶体中与每个K+距离最近的K+有8个,晶体中与每个![]() 距离最近的
距离最近的![]() 有6个
有6个
D. 晶体中其中0价氧和-2价氧的物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA是阿伏加德罗常数的值。下列说法错误的是
A.1 L 0.1 mol/L NH4 NO3溶液中含有氮原子总数为0.2 NA
B.7.8 g Na2 O2与水完全反应,转移的电子数为0.2 NA
C.2.8 g CO和N2混合气体中含有质子数为1.4 NA
D.标准状况下,2. 24 L环丙烷中化学键数目为0.9 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作对应的现象和离子方程式均正确的是( )
操作 | 现象 | 离子方程式 | |
A | 饱和碳酸钠溶液中通入过量CO2 | 无明显变化 | CO |
B | 向苏打溶液溶液中滴加稀硫酸 | 立即产生气泡 | CO |
C | 向Ba(OH)2溶液中加足量NaHCO3溶液 | 生成白色沉淀 | 2HCO |
D | 向NaHCO3溶液中加入少量偏铝酸钠 | 生成白色沉淀和无色气体 | HCO |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃、101kPa下,如右图所示,石墨的燃烧热为393.5kJ/mol,金刚石的燃烧热为395.0kJ/mol 。下列说法或表达正确的是:
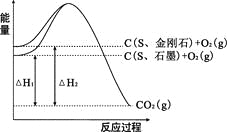
A.金刚石比石墨稳定
B.C(s、石墨)=C(s、金刚石) △H =+1.5kJ/mol
C.△H1<△H2
D.如果使用催化剂,△H1和△H2都变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色植物标本用醋酸铜[(CH3COO)2Cu]处理后颜色更鲜艳、稳定。某化学小组制备醋酸铜晶体并测定产品中铜的含量,实验如下。
Ⅰ.醋酸铜晶体的制备中
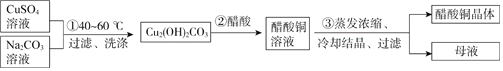
(1)用离子方程式表示过程①产物中OH-的来源:___________;
(2)过程②对应的化学方程式是:___________。
Ⅱ.测定产品中铜的含量
i.取ag醋酸铜产品放入带磨口塞子的锥形瓶中,用稀醋酸溶解,加入过量KI溶液,产Cul沉淀,溶液呈棕黄色;
ii.用b mol·L -1Na2S2O3标准溶液滴定i中的浊液至浅黄色时,加入几滴淀粉溶液,溶液变蓝,继续用Na2S2O3标准溶液滴定至蓝色近于消失;(已知:2![]() +I2=
+I2=![]() +2I-)
+2I-)
iii.向ⅱ所得浊液中加入KSCN溶液,充分摇动,溶液蓝色加深;
iv.继续用Na2S2O3标准溶液滴定中浊液至终点,消耗标准溶液vmL。
已知:①Na2S2O3溶液和Na2S4O6溶液颜色均为无色;
②Cul易吸附I2,被吸附的I2不与淀粉发 CuSCN生显色反应。难溶于水且不吸附I2
(3)i中发生反应的离子方程式是_________;
(4)醋酸铜产品中铜元素的质量分数是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接排放含SO2的烟气会形成酸雨危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应原理为__。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式为__。
(3)吸收液吸收SO2的过程中,pH随n(![]() ):n(
):n(![]() )变化关系如表:
)变化关系如表:
n( | 91:9 | 1:1 | 1:91 |
pH | 8.2 | 7.2 | 6.2 |
①上表判断NaHSO3溶液显性__(填“酸”或“碱”),用化学平衡原理解释__。
②当吸收液呈中性时,溶液中离子浓度关系正确的是(填字母编号)__。
a.c(Na+)=2c(![]() )+c(
)+c(![]() )
)
b.c(Na+)>c(![]() )>c(
)>c(![]() )>c(H+)=c(OH-)
)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(![]() )+c(
)+c(![]() )+c(OH-)
)+c(OH-)
(4)当吸收液的pH降至约为6时,送至电解槽再生。再生示意图如下:
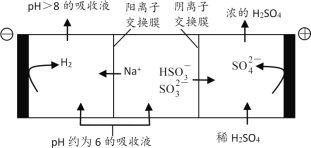
①![]() 在阳极放电的电极反应式是__。
在阳极放电的电极反应式是__。
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图(Ea表示活化能)是CH4与Cl2生成CH3Cl的部分反应过程中各物质物质的能量变化关系图,下列说法正确的是( )
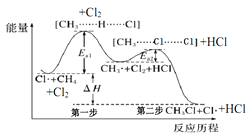
A.Cl·可由Cl2在高温条件下生成,是CH4与Cl2反应的催化剂
B.升高温度,Ea1、Ea2均减小,反应速率加快
C.增大Cl2的浓度,可提高反应速率,但不影响△H的大小
D.第一步反应的速率大于第二步反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三盐(3PbO·PbSO4·H2O,相对分子质量为990)可用作聚氯乙烯的热稳定剂,不溶于水。以200.0t铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如图所示:
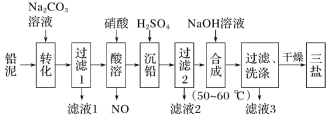
已知:Ksp(PbSO4)=1.82×10-8;Ksp(PbCO3)=1.46×10-13。回答下列问题:
(1)加Na2CO3溶液转化的目的是__。
(2)酸溶时,不直接使用H2SO4溶液的原因可能是__;铅与硝酸在酸溶过程中发生反应的离子方程式为__。
(3)流程中可循环利用的物质是__;洗涤操作时,检验沉淀是否洗涤干净需要的试剂是__。
(4)当沉淀转化达平衡时,滤液l中c(![]() )与c(
)与c(![]() )的比值为__。
)的比值为__。
(5)50~60℃时合成三盐的化学方程式为__;若得到纯净干燥的三盐99.0t,假设铅泥中的铅元素有80%转化为三盐,则铅泥中铅元素的质量分数为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com